Cadeias de nitrogênio somente hidrogenadas, com ligações simples e duplas alternadas, possuem baixa estabilidade química e tendem a se decompor explosivamente a medida em que se aumenta o tamanho da cadeia. Dessa forma, a maioria dos explosivos possui o nitrogênio como princípio básico de seu efeito de detonação. Entretanto, a substituição dos hidrogênios por grupos que deslocalizam a densidade eletrônica, através de efeitos indutivo e mesomérico, tais como grupos fenila (aromáticos) substituídos ou não, conferem maior estabilidade a estas cadeias.
Desde a descoberta de que a substituição dos hidrogênios em nitrogênios terminais da cadeia diazoamínica por determinados grupos orgânicos estabilizam as cadeias nitrogenadas, foi estimulada a síntese de sistemas catenados contendo vários átomos de nitrogênio na mesma cadeia. A partir de então, a síntese desses compostos sofreu uma aceleração, o que imediatamente possibilitou a sua aplicação nos mais diversos meios. A partir da década de 60, após o surgimento de uma instrumentação capaz de elucidar estruturalmente compostos como triazenos, estudos mais aprofundados dessa classe de moléculas tornaram-se viáveis.
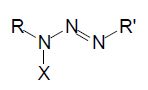
Compostos triazenos são espécies químicas pertencentes à família dos sistemas nitrogenados de cadeia aberta que podem atuar como ligantes em complexos, apresentando três átomos de nitrogênio ligados em sequência, conforme o modelo genérico representado na Figura 1. Pode-se ver que existem três átomos de nitrogênio ligados sequencialmente com ligação simples e dupla, com radicas em suas terminais.
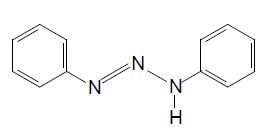
“Foi relatado em 1859 por Peter Griess a primeira síntese de um composto triazeno, o 1,3- bis(fenil)triazeno.”1 Este composto está representado na Figura 2. Pode-se ver que os radicais mostrados na figura anterior foram substituídos por anéis aromáticos, compostos que conferem uma maior estabilidade à molécula, uma vez que permitem a deslocalização eletrônica.
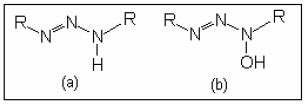
Um triazeno pode ser representado genericamente em (a) e um hidroxitriazeno em (b), onde um átomo de hidrogênio é substituído por um grupo hidroxila (Figura 3), no qual “R” representa grupamentos aromáticos (anéis aromáticos) ou alifáticos (cadeia aberta), que podem ou não conter heteroátomos.
Fator determinante de sua importância e aplicabilidade, compostos dessa natureza podem coordenar-se a vários centros metálicos, além de apresentar a habilidade de impor a estes determinadas geometrias de coordenação, sendo os modos de coordenação de compostos triazenos ou compostos triazenídicos um capítulo à parte, tamanha sua aplicabilidade e pesquisas a respeito.
Leia também:
Referências:
1. MOORE, D. S. & ROBINSON, S. D.; Adv. Inorg. Chem. Radiochem, 30, 1-68, 1986.
LEE, J. D.; Química Inorgânica Não Tão Concisa, Sãp Paulo, Chapman & Hall, 236-239, 1996.
RUSSELL, John B.; Química Geral vol.1, São Paulo: Pearson Education do Brasil, Makron Books, 1994.
Texto originalmente publicado em https://www.infoescola.com/compostos-quimicos/triazenos/