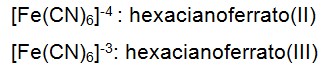O elemento de transição ferro é um metal, com coloração branca prateada em estado quimicamente puro, porém apresenta uma coloração acinzentada, em virtude da presença de sulfeto, siliceto, e carbureto de ferro, apresenta propriedades magnéticas acentuadas. Está localizado na tabela periódica no grupo 8B, e possui:
- número atômico: 26
- massa atômica: 55,85 g mol-1
- ponto de fusão: 1535°C
- ponto de ebulição: 3000°C
- configuração eletrônica: 1s², 2s², 2p6, 3s², 3p6, 4s², 3d6
- número de oxidação: Fe+2 (ferroso ou ferroII) e Fe+3 (férrico ou ferro III)
Na natureza o ferro não está em estado livre ou elementar, porém, é comumente encontrado na forma de pirita FeS, hematita Fe2O3 e Fe3O4, que é transportada para um forno aquecido a uma temperatura de 2000°C, sendo obtido da redução destes compostos. Apresenta 3 formas alotrópicas alfa , gama e delta, sendo a mais estável em temperaturas normais, o ferro alfa. O ferro é conhecido e utilizado pelo homem desde a antiguidade, a sua utilização é vasta em função de ser um metal barato e resistente, apesar da oxidação pelo oxigênio do ar, forma ligas metálicas importantes na indústria tais como o aço-carbono que é uma mistura de ferro e carbono, misturado com níquel e cromo, origina o aço-inoxidável, está presente em inúmeras estruturas metálicas nas construções que nos cercam.
O ferro apresenta em seu estado de oxidação +2, é facilmente oxidado a ferro +3, em virtude deste comportamento é um agente redutor forte, forma complexos quelatos ou por associação de íons, e são facilmente identificados por formar soluções coloridas. A reação pela qual identificamos o ferro mais facilmente é com tiocianato de amônio, devido a coloração vermelho intenso (cor de sangue), reage facilmente com ácidos diluídos ou concentrados, e com bases formando precipitados insolúveis.
Algumas reações mais comuns do ferro:
Meio ácido:
Esta reação é extremamente exotérmica, e libera hidrogênio inflamável.
Meio alcalino:
Formação de um precipitado branco que oxidado a Fe(OH)3(s), a coloração muda para marrom avermelhado.
Reação com tiocianato de amônio (NH4SCN):
Para que esta reação ocorra é necessário que o meio esteja ligeiramente acidificado. Após a reação a coloração da solução é vermelho intenso.
Complexos mais comuns:
O Ferro nos organismos vivos
A importância biológica do ferro está associada ao transporte de oxigênio para as células. Está presente nas hemácias (responsáveis pela coloração vermelha do sangue) formada pelas moléculas de hemoglobina que contém o ferro e é responsável pela oxigenação dos organismos vivos, as alterações na presença do ferro ou a deficiência causa a anemia ou anemia falciforme que é hereditária.
Bibliografia:
Russel, J. B. Química geral. São Paulo: Makron Books, 2004.
Vogel, Arthur Israel, 1905-Química Analítica Qualitativa / Arthur I. Vogel ; [tradução por Antonio Gimeno da] 5. ed. rev. por G. Svehla.- São Paulo : Mestre Jou, 1981 .
http://www.doudou.it/minerali.html
SHRIVER, DUWARD; ATKINS, PETER. Química inorgânica - 4ª edição. Porto Alegre, Bookman, 2008.
LEE, J.D.. Química inorgânica não tão concisa – tradução da 4ª edição inglesa. São Paulo, Edgard Blücher, 1996.
LEHNINGER, A. L. Princípios de Bioquímica. São Paulo: Savier, 1985.
http://www.chemicool.com/
http://www.doudou.it/minerali.html
Texto originalmente publicado em https://www.infoescola.com/elementos-quimicos/ferro/