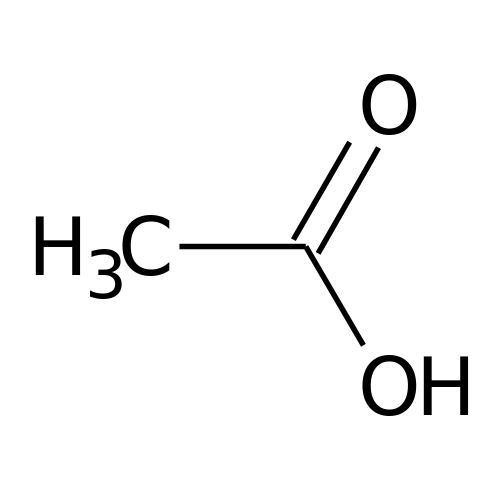
O ácido acético, nome IUPAC ácido etanoico, é um dos principais ácidos carboxílicos. De fórmula molecular CH3COOH, é um ácido orgânico que apresenta grupo funcional carboxila (-COOH), conferindo-o grande polaridade.
 O composto é obtido por meio do metabolismo de micro-organismos, principalmente bactérias, que utilizando uma fonte de carbono em um processo fermentativo o liberam como metabólito. Tem-se conhecimento do ácido acético desde os primórdios da humanidade. O filósofo grego Theophrastos, no século III a.C, retratou o vinagre como uma substância que interagia com metais produzindo pigmentos, muito utilizados nas pinturas da época.
O composto é obtido por meio do metabolismo de micro-organismos, principalmente bactérias, que utilizando uma fonte de carbono em um processo fermentativo o liberam como metabólito. Tem-se conhecimento do ácido acético desde os primórdios da humanidade. O filósofo grego Theophrastos, no século III a.C, retratou o vinagre como uma substância que interagia com metais produzindo pigmentos, muito utilizados nas pinturas da época.
No século VIII, o alquimista persa Jabir Ibn Hayyan o produziu por meio da destilação. Nessa época, acreditava-se que o ácido acético glacial (isento de água) apresentava propriedades diferentes do vinagre. Contudo, o francês Pierre Adet constatou que eram os mesmos compostos.
A primeira síntese do ácido acético a partir de moléculas inorgânicas foi realizada pelo químico alemão Hermann Kolbe, em 1847. A metodologia fundamentava-se na cloração do bissulfeto de carbono, formando tetracloreto de carbono, que por meio de uma reação de pirólise originava o tetracloroetileno. Em seguida, o tetracloroetileno era submetido a cloração e redução eletrolítica, formando o ácido acético. Posteriormente, outras metodologias surgiram como a destilação da madeira para obter ácido acético glacial.
Sua fabricação em escala industrial pode ser realizada pela técnica de oxidação de acetaldeído, etanol, butano ou buteno. Atualmente, a rota mais utilizada é a carbonilação do metanol com monóxido de carbono, catalisada por iodeto de ródio, conforme a reação:
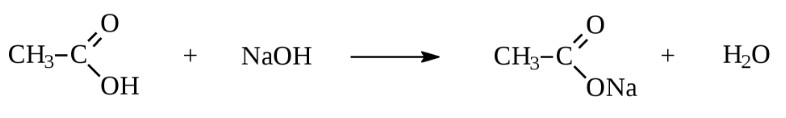
Apresenta características físico-químicas como ponto de fusão de –17ºC, ponto de ebulição de 117ºC, líquido incolor de odor purgente e corrosivo. A presença do grupo funcional carbonila permite que a molécula realize ligações de hidrogênio, promovendo maior ponto de fusão e ebulição em comparação com ésteres e álcoois. É solúvel em água, etanol e miscível na maioria dos solventes orgânicos. De modo análogo aos compostos inorgânicos, mudam a cor de indicadores ácido-base e reagem com bases formando sais orgânicos, conforme indicado no esquema:
O ácido acético participa na preparação de diversos materiais como acetatos metálicos empregados em processos de impressão; acetato de celulose para produção de têxteis e filmes fotográficos; acetato de vinila utilizado nos processos de polimerização para formação do cloreto de vinila (PVC); e ésteres orgânicos voláteis largamente usados em solventes para tintas, resinas e lacas.
A produção de vinagre para consumo alimentício deve ser realizada por rota fermentativa, especificamente a partir do vinho. Os produtos resultantes de outras matérias-primas são chamados de fermentados acéticos. No Brasil, os vinagres são elaborados de uma mistura a partir do álcool de cana-de-açúcar e do vinho.
Referências bibliográficas:
FONSECA, Martha Reis Marques da. Química: ensino médio. – 2. ed. – São Paulo: Ática, 2016.
NOVAIS, V. D. L. & ANTUNES, M. T. Vivá: química: volume 3: ensino médio. – Curitiba: Positivo, 2016.
https://www.britannica.com/science/acetic-acid
https://www.fca.unicamp.br/portal/images/Documentos/FISPQs/FISPQ-%20Acido%20Acetico.pdf
https://pt.wikipedia.org/wiki/%C3%81cido_etanoico
Texto originalmente publicado em https://www.infoescola.com/quimica/acido-acetico/