De acordo com a teoria de Arrhenius, base é toda a substância que aumenta a concentração de íons hidroxila (OH-) pela sua dissociação em meio aquoso. Assim, aumenta o pH do meio e diminui, por consequência, o pOH. De um modo geral, possuem sabor adstringente, além de reagirem com ácidos de Arrhenius formando algum sal e água.
Conteúdo deste artigo
Classificação
As bases de Arrhenius seguem determinadas classificações que, em tese, dependem do número de hidroxilas ligadas ao átomo central.
Quanto ao número de OH- da molécula:
- Monobases: KOH, NaOH, LiOH;
- Dibases: Mg(OH)2, Ca(OH)2, Ba(OH)2;
- Tribases: Al(OH)3, Fe(OH)3;
- Tetrabases: Sn(OH)4, Pb(OH)4;
Quanto à força (capacidade de dissociação):
- Fortes: Todos os hidróxidos de metais das famílias 1A e 2A. A exceção dos hidróxidos de berílio e de magnésio;
- Fracas: Os demais hidróxidos metálicos e de amônio (NH4OH);
Quanto à solubilidade (meio aquoso);
- Solúveis: Todos os hidróxidos da família 1A e o hidróxido de amônio;
- Pouco solúveis: Hidróxidos da família 2A, em geral;
- Insolúveis: As demais bases. Sendo que, uma ínfima parcela sempre se dissolve, mas é desconsiderada em relação ao total.
Reações de Neutralização
A partir da definição de Arrhenius para um ácido e para uma base, a reação entre esses dois compostos, em solução aquosa, liberará algum sal (com pelo menos um cátion diferente de H+ e um ânion diferente de OH-) e moléculas de água líquida.
Uma reação de neutralização pode ser esquematizada da seguinte maneira:
HA(aq) + BOH(aq) -> AB(aq) + HOH(l)
Vale lembrar que esta reação genérica é de uma neutralização total. Ou seja, o sal gerado é neutro (não possui OH- ou H+ em sua molécula-íon). Para o caso de um sal ácido ou básico gerado, seguem as seguintes reações como exemplo (para efeito de análise, deve-se considerar que as espécies químicas das reações são 100% dissociáveis):
a) Sal ácido (Hidrogenossal):
H2SO4 + NaOH -> NaHSO4 + H2O
H2CO3 + NaOH -> NaHCO3 + H2O
b) Sal básico (Hidroxissal):
HCl + Mg(OH)2 -> Mg(OH)Cl + H2O
Fe(OH)3 + H2SO4 -> Fe(OH)SO4 + H2O
Constante de Dissociação de uma Base
A constante de dissociação de uma base (Kb) é maior tanto quanto é a força desta. Assim, em bases fracas, Kb é um número pequeno.
O valor de Kb pode ser calculado da seguinte maneira (para uma base BOH genérica):
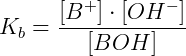
Onde, [B+] = concentração do cátion liberado pela base, [OH-] = concentração íons OH- liberados, [BOH] = concentração da base não dissociada.
Portanto, para bases fortes (cuja concentração base não dissociada é quase zero) os valores dessa constante tendem a números muito grandes e são, portanto, considerados indetermináveis.
Texto originalmente publicado em https://www.infoescola.com/quimica/bases-de-arrhenius/