Conceitualmente, isótopos são átomos que possuem o mesmo número de prótons, ou seja, são espécies distintas do mesmo elemento, diferindo apenas no número de massa e de nêutrons.
Os isótopos em geral possuem mesmas propriedades químicas, visto que esse tipo de propriedade só depende do número atômico, como é o caso da solubilidade. No entanto, podem apresentar diferentes propriedades físicas devido a suas massas serem diferentes, como é o caso da densidade.
Os isótopos de um mesmo elemento possuem abundâncias naturais diferentes, ou seja, são encontrados na natureza em quantidades distintas uns dos outros. O cálculo da massa de um elemento químico é feito utilizando-se a massa e a abundância natural de cada isótopo daquele elemento. Sendo assim o isótopo mais abundante é aquele que contribui mais para as características químicas do elemento na Tabela Periódica.
Ex.: O cloro possui dois isótopos:
| Isótopo | Abundância Isotópica (%) | Massa Relativa (u) |
| Cl35 | 75,76 | 34,969 |
| Cl37 | 24,24 | 36,966 |
A massa atômica relativa do cloro é dada pela média ponderada entre suas abundâncias isotópicas:
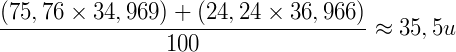
A massa arredondada que observamos para o oxigênio na Tabela Periódica é 16u., sendo este valor uma maior contribuição (99,75%) do isótopo de massa 15,994 u. do que de seus outros dois isótopos, O17 e O18.
Os radioisótopos são átomos que apresentam um núcleo radioativo, podendo liberar radiação ao se transformar em um outro isótopo (decaimento radioativo). Estes isótopos são muito utilizados em diversas aplicações, desde a obtenção de energia até na medicina para tratamentos radioterápicos.
A utilização de radioisótopos no tratamento de câncer é geralmente feita ligando-se um destes radioisótopos a uma molécula que o leve até a célula cancerosa. Quando o radioisótopo decai, ele emite radiações que ionizam o DNA da célula cancerosa e inibem seu crescimento.
Isótopos importantes:
Conteúdo deste artigo
Isótopos do Hidrogênio
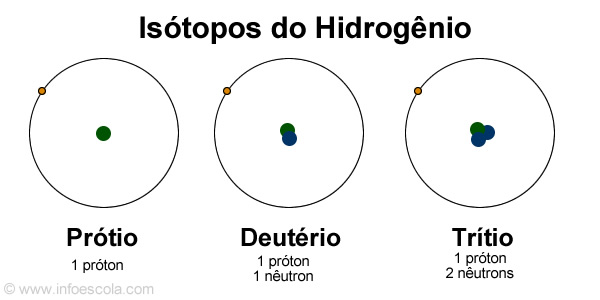
O elemento hidrogênio possui 3 isótopos conhecidos, sendo eles:
- 1H1 – prótio (cerca de 99,98%)
- 1H2 – deutério - hidrogênio que possui um nêutron (cerca de 0,015%).
- 1H3 – trítio - hidrogênio que possui dois nêutrons, e é radioativo (apenas traços).
Isótopos do Carbono
O carbono possui dois isótopos naturais:
- 6C12 – carbono 12, mais abundante na Terra (cerca de 98,89%).
- 6C13 – carbono 13, menos abundante (cerca de 1,01 a 1,14%).
- 6C14 – carbono 14, apenas traços na natureza, é radioativo e por esta razão é utilizado para fazer o processo de datação de artefatos geológicos.
Como funciona a datação por carbono 14?
A técnica de datação por carbono-14 foi descoberta na década de 1940 por Willard Libby. Ele utilizou um contador Geiger para medir a radioatividade do C-14 existente em diversos objetos e percebeu que a quantidade de C-14 decaia a um ritmo constante após a morte de um organismo vivo. Ele fez a análise de artefatos com datação documentada e comparou com a radiação observada por ele, podendo assim determinar a idade média do artefato. Esta técnica é considerada viável para objetos de até 70 mil anos e é aplicável à madeira, carbono, sedimentos orgânicos, ossos, conchas marinhas - ou seja, todo material que conteve carbono em alguma de suas formas, e o absorveu, mesmo que indiretamente, como pela alimentação com organismos fotossintetizantes, da atmosfera.
Texto originalmente publicado em https://www.infoescola.com/quimica/isotopos/