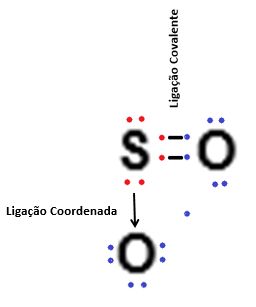
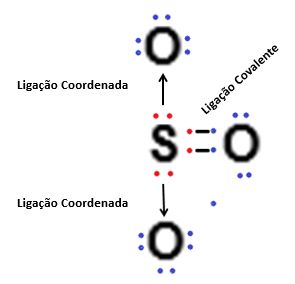
As ligações covalentes ocorrem quando há o compartilhamento de elétrons entre os átomos, tornando todos os átomos que participam deste tipo de ligação estáveis, porém, no caso da ligação covalente coordenada ou dativa, o átomo que possui pares de elétrons disponíveis e que não está realizando o compartilhamento deles com outro átomo pode “doar” estes elétrons livres para um outro átomo qualquer, realizando desta forma uma ligação covalente simples e uma ligação covalente coordenada ou dativa, onde há a transferência de elétron(s) de um átomo para o outro. Este tipo de ligação química é bastante comum e ocorre frequentemente com átomos de cloro, enxofre, fósforo, entre outros diversos elementos químicos.
Para que uma ligação covalente coordenada ocorra é necessário que um dos átomos compartilhe um par de elétrons com outro átomo, e ao mesmo tempo, faça cessão de um ou mais elétron(s) com outro átomo, que apenas participa da ligação recebendo o(s) elétron(s). Para facilitar o entendimento, vejamos como esse tipo de ligação funciona:
A ligação covalente coordenada ocorre somente se o átomo que é responsável pela doação de elétron(s) estiver estabilizado de acordo com a regra do octeto, ou seja, primeiramente ocorre o compartilhamento dos elétrons com um átomo, até que ambos estejam estáveis, para somente após esta estabilização ocorrer a doação do(s) elétron(s) para o outro átomo tornar-se estável.
Na simbologia de Lewis, as ligações onde ocorrem a doação de elétrons são representadas por setas (→) e as ligações onde ocorre o compartilhamento de elétron são representadas por um hífen ligando os elétrons (• ─ •).
Para alguns elementos químicos, de acordo com sua distribuição eletrônica, torna-se possível prever a quantidade de ligações covalentes simples e coordenadas que podem ocorrer. Para os elementos pertencentes às famílias do Hidrogênio, IVA, VA, VIA e VIIIA é possível verificar informações relativas às ligações covalentes, como podemos observar na tabela a seguir:
| Tabela de ligações covalentes simples e coordenadas | |||||
| Tipo de ligação | Família do elemento químico | ||||
| Hidrogênio | IVA | VA | VIA | VIIIA | |
| Quantidade de ligações | |||||
| Covalente simples | 1 | 4 | 3 | 2 | 1 |
| Covalente coordenada | 0 | 0 | 1 | 2 | 3 |
As ligações coordenadas, tanto as simples quanto as coordenadas possuem força de ligação inferiores às ligações do tipo iônica e metálica. Por esse motivo são ligações químicas mais sensíveis e que possuem maior facilidade de serem rompidas. Porém, em alguns casos há exceções onde a força de interação entre as moléculas permite que algumas substâncias formadas por ligações covalentes sejam encontradas no estado sólido, como por exemplo o iodo, o carbono em forma de diamante e a sílica.
Os principais elementos químicos que participam de ligações covalentes são os ametais e semimetais: Hidrogênio, Boro, Carbono, Silício, Germânio, Nitrogênio, Fósforo, Arsênio, Antimônio, Oxigênio, Enxofre, Selênio, Telúrio, Polônio, Flúor, Cloro, Bromo, Iodo e Astato.
As ligações covalentes podem ser polares e apolares, dependendo da eletronegatividade dos átomos que participam da ligação química. A ligação covalente do tipo polar é estabelecida entre átomos com diferentes eletronegatividades, já as do tipo apolares são estabelecidas entre átomos com mesma eletronegatividade.
Referências bibliográficas:
BIANCHI, J. C. de A. Universo da Química: Ensino Médio: Volume único. 1. Ed. São Paulo: FTD, 2005.
SANTOS, W. L. P.dos.; MOL, G. de S. Química Cidadã: Volume 1: Ensino Médio. 2. ed. São Paulo: AJS, 2013.
FONSECA, M.R.M. da. Química 1. 1. ed. São Paulo: Ática, 2013.
http://www.zezinho.net/intranet/arquivos/2013-03-16_21-43_ligaacaoes_covalentes.pdf
Texto originalmente publicado em https://www.infoescola.com/quimica/ligacao-covalente-coordenada-ou-dativa/