A tabela periódica dos elementos químicos é conhecida como uma ótima fonte de informação quando se deseja saber características sobre os elementos, como: verificar quais são metais, quais os mais densos, os mais pesados ou reativos. Entretanto, a tabela periódica nem sempre foi assim, organizada e completa: dispor os elementos obedecendo as suas semelhanças já foi motivo de muita discussão e estudo científico, e, embora a tabela atual seja mais eficiente, sua formação é derivada de tantas outras mais primitivas.
Conteúdo deste artigo
Classificação de Döbereiner - Lei das Tríades (1829)
Johann W. Döbereiner (1780-1849), cientista alemão, observou que muitos elementos podiam ser agrupados três a três (tríades) de acordo a certas semelhanças com as massas atômicas:
- Proximidade
Fe = 56u
Co = 59u
Ni = 58u
Como se pode perceber, o Ferro, o Cobalto e o Níquel possuem massas atômicas muito próximas. - Diferença comum
Li = 7u
Na = 23u
K = 39u
Observe que, a diferença entre as massas dos elementos consecutivos na ordem crescente é igual a 16. De fato: 23 - 7 = 16; 39 - 23 = 16. - Média aritmética
Ca = 40u
Sr = 88u
Ba = 137u
Efetuando-se a média aritmética entre as massas do Cálcio e do Bário obtém-se a massa atômica aproximada do Estrôncio: 137+40 = 177; 177/2 = 88,5.
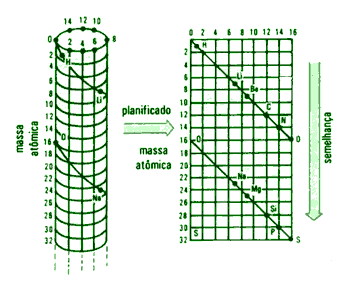
Classificação de Chancourtois - Parafuso Telúrico (1862)
Alexander Béguyer de Chancourtois (1820-1886), geólogo francês, organizou os elementos da seguinte forma: inicialmente, dividiu a superfície de um cilindro em 16 colunas e inúmeras horizontais; atribuiu ao oxigênio a massa 16u; traçou uma linha helicoidal que começava pelo oxigênio (ponto 0) e terminava no décimo sexto elemento mais pesado, até onde a linha alcançava. Repetiu esse procedimento até que todos os elementos fossem alocados nas linhas divisórias.
A tabela adquiriu uma aparência similar a esta:
Considera-se elementos semelhantes aqueles que se encontram na mesma vertical, como o Carbono e o Silício; Nitrogênio e Fósforo.
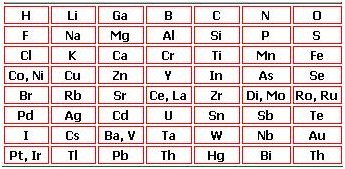
Classificação de Newlands - Lei das Oitavas (1864)
John A. R. Newlands (1838-1898), professor de química e industrial inglês, idealizou a classificação dos elementos pela ordem crescente de massa atômica, em grupos de 7 e dispostos lado a lado. Logo percebeu que as propriedades químicas eram semelhantes ao primeiro e oitavo elementos – a contar da esquerda para a direita -, como as notas musicais que se repetem a cada oitava.
Assim, os elementos que seguem a mesma linha vertical possuem as mesmas características químicas, como o Lítio, o Sódio e o Potássio; o Magnésio e o Cálcio.
O Fracasso das classificações antigas e o modelo atual
Apesar de promissoras, os modelos antigos de classificação dos elementos apresentaram muitas incompatibilidades:
- Lei das Tríades
Esse método de distribuição foi considerado ineficaz porque era muito restrito e só atendia a alguns elementos. - Parafuso Telúrico
A aceitação desse método foi pequena, pois os valores das massas atômicas eram, muitas vezes, errôneos e imprecisos. - Lei das Oitavas
Esse modelo também foi banido por apresentar problemas, novamente, com os valores das massas atômicas. Ou seja, alguns elementos estavam em lugares errados: o cloro e o flúor, por exemplo, não possuem características semelhantes ao Cobalto ou ao Níquel.
Apesar de fracassados, esses modelos contribuíram para o constante aperfeiçoamento sobre a classificação dos elementos químicos.
Dois cientistas trabalharam isoladamente um do outro, mas chegaram a resultados parecidos, foram eles: Julius Lothar Meyer (1830-1895) e Dmitri Ivanovitch Mendeleev (1834-1907), sendo o trabalho de Mendeleev mais ousado.
Mendeleev apresentou seu modelo de classificação dos elementos à real Sociedade Russa de Química, onde obteve grande aceitação. A sua teoria pode ser confirmada com algumas observações suas:
- “Os elementos, se dispostos de acordo com as massas atômicas, revelam evidente periodicidade de propriedades;
- Devemos esperar a descoberta de muitos elementos ainda desconhecidos; por exemplo, elementos análogos ao alumínio (eka-Alumínio) e ao silício (exa-Silício), cujas massas atômicas ficariam compreendidas entre 65 e 75”
Ou seja, Mendeleev afirmava que as propriedades dos elementos são uma função periódica de suas massas atômicas.
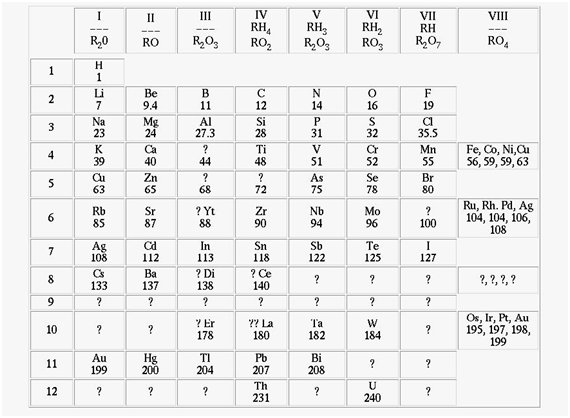
Tabela periódica idealizada por Mendeleev, em 1869, apresentando espaços vagos para a inclusão de novos elementos.
A tabela periódica atual não é uma cópia fiel da tabela de Mendeleev: é mais aperfeiçoada. Não pela aparição de elementos que ocupam os espaços vazios destinados a eles, mas por causa de um conceito estabelecido em 1913: o número atômico.
Henry G. L. Moseley definiu que a verdadeira identidade de um elemento não está relacionada diretamente com a massa dele, mas com a carga nuclear do átomo que o representa. Assim, modificou levemente a tabela proposta por Mendeleev, permanecendo sua essência até hoje.
Fontes:
MAHAN Bruce M., MYERS Rollie J. Química: um curso universitário, São Paulo – SP: Editora Edgard Blücher LTDA, 2005. 4ª tradução americana, 7ª reimpressão. 592 págs.
SARDELLA, Antônio. Curso de química: Química geral, São Paulo – SP: Editora Ática, 2002. 25ª Edição, 2ª impressão. 448 págs.
http://pt.wikipedia.org/wiki/História_da_Tabela_Periódica (acesso em 19/03/2010)
http://www.10emtudo.com.br/imprimir_artigo.asp?CodigoArtigo=10 (acesso em 19/03/2010)
http://web.fccj.org/~ethall/period/period.htm (acesso em 19/03/2010)
Texto originalmente publicado em https://www.infoescola.com/quimica/historia-da-tabela-periodica/