O núcleo de um átomo é constituído por prótons e nêutrons, e a seu redor está a eletrosfera, onde os elétrons ficam se movimentando, em movimentos circulares. A eletrosfera é constituída por camadas ou níveis de energia, cada camada possui um subnível:
| Camada | Subníveis |
|---|---|
| K | s |
| L | s, p |
| M | s, p, d |
| N | s, p, d, f |
| O | s, p, d, f |
| P | s, p, d |
| Q | s, p |
No subnível s cabem apenas 2 elétrons, no p 6 elétrons, no d 10 elétrons e no f até 14 elétrons. Como representado abaixo:
K 1s2
L 2s2 2p6
M 3s2 3p6 3d10
N 4s2 4p6 4d10 4f14
O 5s2 5p6 5d10 5f14
P 6s2 6p6 6d10
Q 7s2
Esse diagrama é chamado de Diagrama de Linus Pauling, onde é possível distribuir os elétrons dos elementos químicos. Exemplo: O átomo de oxigênio possui 8 elétrons na sua camada de valência (O8) , logo sua distribuição eletrônica será:
K 2 elétrons 1s2
L 6 elétrons 2s2 2p4
Logo, a somatória dos elétrons distribuídos é igual a oito.
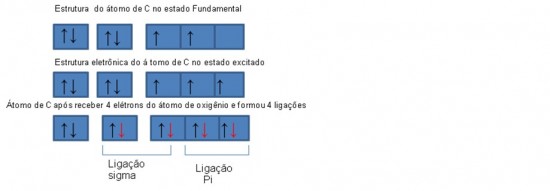
Alguns elementos como o carbono, enxofre, silício, oxigênio e o nitrogênio sofrem hibridização, ou seja, eles formam orbitais híbridos onde os subníveis s e p se misturam. Exemplo no gás metano o carbono precisa fazer 4 ligações, mas a distribuição eletrônica dele é 1s2 2s2 2p2 porque seu número atômico é 6. O subnível 1 s2 está completo com 2 elétrons o subnível 2s2 também tem 2 elétrons, mas 1 elétron sai desse subnível e vai para o subnível 2 pé o que chamamos de hibridização Sp3. Isso ocorre para que o carbono faça quatro ligações.
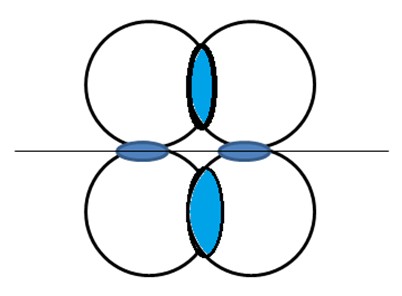
Nas ligações duplas ou triplas há uma interação lateral dos orbitais, originando a ligação PI (π). A densidade eletrônica neste tipo de ligação está limitada entre os átomos unindo-os.
A figura abaixo ilustra as interpolação lateral dos orbitais representado na vertical, que originam as ligações π .
Exemplo de ligação PI para o dióxido de carbono CO2.
Neste caso o átomo de Carbono deve ser excitado para fornecer quatro elétrons desemparelhados, para formar as quatro ligações existentes na molécula. As ligações pi não alteram a estrutura da molécula de CO2, porém diminui a distância entre o Carbono e o Oxigênio.
Referências consultadas:
LEE, J. D. Química inorgânica não tão concisa.São Paulo: Edgard Blucher LTDA, 1999 pagina 46.
Texto originalmente publicado em https://www.infoescola.com/quimica/ligacao-pi/