O trióxido de enxofre é uma molécula formada por ligações duplas covalente entre átomos de S e O, cuja fórmula molecular é SO3. Apresenta geometria trigonal plana com ângulos de 120º entre as ligações S=O, e por isso o momento dipolo da molécula é nulo, o que confere a ela um caráter apolar. É conhecido também como anidrido sulfúrico ou óxido sulfúrico, e o átomo de enxofre apresenta estado de oxidação +6 e uma carga formal +3. A molécula de SO3 tem massa molecular de 80,06 g/mol, e seus pontos de fusão e ebulição são de 16,9 ºC e 45 ºC respectivamente. Em temperatura ambiente pode ser encontrado na forma de líquido incolor fumegante, com densidade de 1,92 kg/m3. Na forma gasosa, é um composto poluente, irritante, corrosivo, sendo um dos principais causadores da chuva ácida. Entre os problemas de saúde causados pelo SO3 estão as doenças respiratórias, especialmente bronquites e em casos mais graves o enfisema pulmonar e ainda problemas cardiovasculares. É um composto estável, porém incompatível com matéria orgânica, metais, bases e cianetos reagindo fortemente com água e com oxigênio. É bastante higroscópico, e seu calor de hidratação pode provocar a ignição de madeira ou algodão, pois desidrata os carboidratos presentes nas estruturas desses materiais.
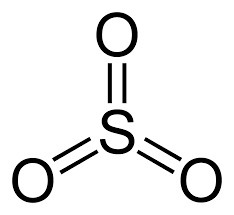
O SO3 é obtido através da reação do dióxido de enxofre (SO2) purificado com oxigênio atmosférico (temperatura de 400 a 600 ºC) na presença de pentóxido de vanádio (V2O5) como catalisador da reação. Esse processo é chamado contato direto e o catalisador é ativado com óxido de potássio em suporte de terra diatomácea ou sílica.
Essa reação é reversível e acontece de forma lenta em temperatura controlada, entretanto o aumento de temperatura pode deslocar o equilíbrio no sentido da produção de SO2 e O2. Para tornar a reação mais rápida, sem a perda de SO3, pode-se fazer a adição de catalisadores a base de nitrato de potássio.
SO2 + NO2 → SO3 + NO
Também pode ser obtido através da combustão de compostos sulfetados que são formados nas chaminés de fábricas. Em laboratório pode ser produzido pela reação de pirólise do bissulfato de sódio (NaHSO4).
Desidratação a 315ºC: 2 NaHSO4 → Na2S2O7 + H2O
Cracking a 460ºC: Na2S2O7 → Na2SO4 + SO3
O SO3 é considerado um ácido de Lewis, recebe elétrons, sendo um ácido mais forte que o SO2, e com isso reage diretamente com água formando ácido sulfúrico (H2SO4).
SO3(g) + H2O(l) → H2SO4(l)
Essa reação explica porque o SO3 é um dos gases que contribuem para o problema da chuva ácida, uma vez que a presença de H2SO4, que é um ácido forte, diminui o pH da água da chuva. Isso causa uma série de problemas, pois altera o pH dos ambientes aquáticos, do solos , causando desequilíbrios nesses ecossistemas. Além disso, a chuva ácida causa danos nas cidades destruindo monumentos, edificações, pontes, veículos, e até mesmo tintas pelo processo de corrosão.
Em função dos problemas de saúde e ambientais provocados pelo SO3 ele está presente na lista de indicadores da qualidade do ar do Conselho Nacional de Meio Ambiente (CONAMA).
Referencias:
Atkins, P. W.; Jones, Loretta . Princípios de química: questionando a vida moderna e o meio ambiente. Volume único. 3. ed. Porto Alegre: Bookman, 2006.
Cardoso, A.A.; Pitombo, L.R.M. Contribuição dos compostos reduzidos de enxofre no balanço global do estoque de enxofre ambiental. Química Nova, v. 15, p. 219, 1992.
Indicadores de Qualidade do ar Conselho Nacional de Meio Ambiente (CONAMA) disponível em http://www.mma.gov.br/port/conama/ acessado em abril de 2019.
Kotz, J. C. Química Geral e Reações Químicas. Volume 1, 9ª edição, Cengage Learning, 2015.
Tito e Canto. Química na Abordagem do Cotidiano. Volume único, partes A e C – Química Orgânica. Editora Saraiva 2005.
Silva, L. A.; Carvalho, L. S.; Lopes, W. A.; Pereira, P. A. de Paulo.; Andrade, J. B. Solubilidade e reatividade de gases. Química Nova, Vol. 40, No. 7, 824-832, 2017
Texto originalmente publicado em https://www.infoescola.com/quimica/trioxido-de-enxofre/