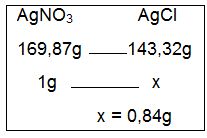Uma reação química não pode ser considerada como um sistema ideal, ou seja, que poderá ser previsto quantitativamente em exatidão. Vários fatores podem estar envolvidos em um processo laboratorial cujo resultado obtido não satisfez o teorizado. “A palavra estequiometria vem do grego e significa medir algo que não pode ser dividido. Ela foi empregada pela primeira vez pelo químico alemão J. B. Richter, que em 1972 publicou Anfangsgründe der Stöchyometrie (Fundamentos de Estequiometria). Hoje a estequiometria compreende os requisitos atômicos das substâncias que participam de uma reação química, particularmente no que diz respeito ao peso”.
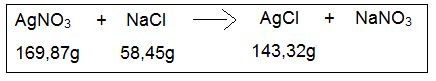
Por exemplo, uma dada reação química de precipitação entre 1g de nitrato de prata (AgNO3) e 0,34g de cloreto de sódio (NaCl), massas sem excesso, após pesada a massa precipitada de um dos produtos formados, o cloreto de prata (AgCl), após isolamento por filtração seguida por evaporação, observou-se um valor levemente abaixo do esperado, equivalente a 0,6g deste sal. Esse fato deve-se principalmente a fatores de impurezas dos reagentes utilizados. Essa reação em questão está equacionada abaixo, e está previamente com seus coeficientes estequiométricos ajustados, ou seja, a massa dos reagentes é igual à massa dos produtos, juntamente com os pesos moleculares das espécies envolvidas.
Dessa forma, deve-se primeiramente calcular a massa teórica esperada de AgCl, para então compará-la com a massa realmente obtida. O método empregado pode ser uma regra de três simples, considerando-se apenas um dos produtos envolvidos, uma vez que não há excesso de reagentes. Usaremos para fins de cálculos o AgNO3, o qual terá sua massa molecular relacionada à massa molecular do produto em destaque; na primeira linha da regra de três. Na segunda linha, relacionaremos a massa que reage com a massa teórica esperada do produto.
O cálculo indica que seriam esperadas 0,84g de AgCl, caso tivéssemos um rendimento teórico de 100%. Entretanto, sabemos que a massa obtida deste produto foi de 0,60g, portanto, podemos calcular o rendimento da reação química, também através de uma regra de três simples. Nesta, consideramos como 100% a massa de produto esperada e relacionamos a massa obtida com a variável, conforme podemos observar abaixo:
Observamos dessa forma que o rendimento reacional foi de 71,42%, o que nos demonstra erros operacionais durante o procedimento laboratorial de síntese ou qualidade inferior dos reagentes utilizados, os quais não permitiram que obtivéssemos a massa esperada (0,84g) do produto considerado, mas apenas 0,6g, validando a afirmação de que a maioria dos processos laboratoriais não ocorre de modo ideal.
Referências:
MAHAN, B.; MYERS, R.; Química: um curso universitário, Ed. Edgard Blucher LTDA, São Paulo/SP, 2002.
Texto originalmente publicado em https://www.infoescola.com/quimica/rendimento-de-uma-reacao-quimica/