Os ácidos são muito encontrados em nosso cotidiano, desde os medicamentos que usamos até os alimentos que ingerimos. Exemplos disso são o ácido acetilsalicílico, princípio ativo da aspirina e o ácido cítrico que se encontra presente no limão.

Foto: digitalconsumator / Shutterstock.com
São compostos que em solução aquosa se ionizam e produzem o íon hidrônio H3O+ ou simplesmente H+ como único cátion. Esta teoria foi proposta em 1887 por Arrhenius, um Químico sueco, e se baseava na condutividade elétrica dos íons em solução.
Estas substâncias possuem as características abaixo:
- Formam soluções condutoras de eletricidade pois ao se ionizarem liberam íons responsáveis por esse processo;
- Mudam a coloração de certas substâncias, no caso os indicadores;
- Possuem sabor azedo, como é o caso do vinagre devido ao ácido acético presente.
Para definir a concentração de íons H+ em solução foi criada a escala de pH - sigla usada para o termo potencial hidrogeniônico. Esta escala varia de 0 a 14 sendo que as substâncias que possuem pH < 7 são consideradas ácidas, pH = 7 são consideradas neutras e pH > 7 são básicas. Esses valores são encontrados através de cálculos matemáticos a partir da fórmula pH= -log [H+].
Alguns indicadores são utilizados para constatar se uma substância é ácida ou não através de sua coloração que muda devido ao potencial hidrogeniônico da solução e os mais conhecidos e utilizados são: solução de fenolftaleína, papel de tornassol e papel indicador universal. Em laboratórios podemos também encontrar o pHmetro que é um equipamento utilizado para medições mais exatas e precisas. Alguns indicadores podem ser produzidos em casa como é o caso do suco do repolho roxo.
Os ácidos podem ser classificados de acordo com o número de hidrogênios ionizáveis (monoácidos, diácidos, triácidos), a presença ou não do elemento oxigênio (hidrácidos ou oxiácidos) e por fim de acordo com sua força. A sua fórmula é formada por uma parte positiva que é sempre o H+ seguida de um grupamento ou átomo de carga negativa. Sendo então a fórmula geral HxA onde o número de hidrogênios varia de tal modo que a soma das cargas da molécula seja igual a zero, pois a mesma deve ser eletricamente neutra.
Confira abaixo os principais ácidos:
Conteúdo deste artigo
Ácido Sulfúrico
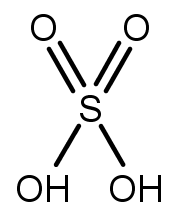
Ácido sulfúrico.
O ácido sulfúrico (H2SO4) é um dos compostos mais importantes dessa classe e é utilizado na produção de superfosfatos que são fertilizantes agrícolas, na limpeza de ligas metálicas e metais em geral, nas refinarias de petróleo, na produção de plásticos, em baterias de automóveis, entre outros. Por ser o produto químico mais usado na indústria podemos medir o desenvolvimento industrial de um país de acordo com sua taxa de consumo.
Ácido clorídrico
De fórmula molecular HCl é um ácido muito utilizado na indústria alimentícia, na produção de tintas em geral, além de ser encontrado inclusive no suco gástrico do estômago para auxiliar no processo da digestão. O ácido muriático é o ácido clorídrico na forma impura e é utilizado na limpeza de pisos em geral.
Ácido nítrico
Este ácido de fórmula HNO3 é derivado da amônia e possui diversas aplicações, entre elas: produção de fertilizantes, explosivos e medicamentos.
Referências: FELTRE, R. Química Geral. Vol 1. 6ª edição. Editora Moderna: São Paulo, 2004.
Texto originalmente publicado em https://www.infoescola.com/quimica/acido/