Complexos tetracoordenados, ou seja, que apresentam o íon metálico central (ácido de Lewis, espécie que aceita pares de elétrons) coordenado por quatro ligantes (bases de Lewis, espécie que doa pares de elétrons) apresentam duas estruturas geométricas principais: a tetraédrica e a quadrado-planar. As espécies que apresentam a geometria quadrado-planar são menos comuns, e podem envolver, por exemplo, os metais platina e níquel, nos ânions ([PtCl4]2-) e [Ni(CN)4]2-). Os complexos quadrado-planares são característicos nos íons de metais de transição com configurações eletrônicas terminadas em d8 ou s¹d7.
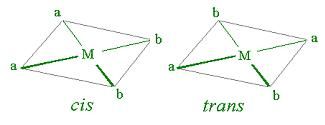
O tipo de geometria quadrado-planar pode apresentar isomeria geométrica, conhecida também como isomeria cis-trans, conforme mostrado na Figura 1.
Mas para complexos coordenados por quatro ligantes é mais comum a geometria tetraédrica, a qual é encontrada nos íons de cobalto e cromo, por exemplo, cujos ânions podem ser ([CoCl4]2- e [CrO4]2-). Essa isomeria é encontrada nos complexos dos metais representativos ou dos metais de transição com configuração eletrônica de terminação diferente de d8 ou s¹d7, comuns para os complexos quadrado-planares. Entretanto, em um complexo tetraédrico, os quatro ligantes ocupam os vértices matemáticos de um tetraedro regular, o que lhes confere posições equivalentes, não sendo possível a existência de isômeros geométricos.
Mas os complexos com geometria tetraédrica podem apresentar isomeria óptica, de modo análogo aos compostos orgânicos. Mas, para que isso ocorra, o íon metálico deve ligar-se a quatro ligantes diferentes entre si. Tais complexos, denominados de enantiômeros ou isômeros ópticos, são opticamente ativos, pois apresentam a propriedade de girar o plano de luz polarizada, mesmo quando em solução. Exemplos de composto tetraédrico que apresentam isomeria óptica são os enantiômeros do bis (benzoilacetonato), quando este envolve o íon metálico berílio.
Em alguns momentos estes compostos apresentam dificuldade de separação, o que se deve a formação de uma mistura racêmica, quando ambos complexos estão em mesma proporção na amostra, ou seja, 50% da amostra é composta por moléculas dextrógiras (desviam o plano de luz polarizada para a direita), e o restante por moléculas levógiras (desviam o plano de luz polarizada para a esquerda).
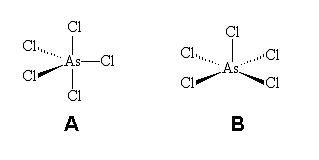
O número de coordenação cinco também pode ser encontrado em complexos, embora espécies contendo este número de coordenação sejam mais raras do que aquelas com número de coordenação igual a quatro ou seis. Entretanto, para NC = 5, duas possibilidades de geometrias moleculares tornam-se possíveis, a bipirâmide trigonal (A) e pirâmide de base quadrada (B), mostradas na Figura 2.
Compostos de coordenação com número de coordenação 5 não apresentam nenhum tipo de isomeria geométrica. Exemplos para essas moléculas podem ser encontrados com o níquel e o cobalto como íons metálicos centrais.
Referências:
ATKINS, P.; JONES, L.; Princípios de Química: questionando a vida moderna e o meio ambiente, Porto Alegre, Bookman, 2001.
Texto originalmente publicado em https://www.infoescola.com/quimica/isomerismo-em-compostos-de-coordenacao-de-nc-4-e-nc-5/