O elemento químico nitrogênio está localizado na Família 5A da Tabela Periódica (grupo 15), o que o classifica como pertencente à família do nitrogênio (átomos que apresentam 5 elétrons na camada de valência). A sua configuração eletrônica, razão desta sua classificação, é 1s22s22p3, o que mostra que o átomo de nitrogênio possui cinco elétrons em sua camada de valência (última camada, camada L no caso do nitrogênio).
O elemento químico oxigênio está localizado na Família 6A da Tabela Periódica (grupo 16), o que o classifica como pertencente à família dos calcogênios (átomos que apresentam 6 elétrons na camada de valência). A sua configuração eletrônica, razão desta sua classificação, é 1s22s22p4, o que mostra que o átomo de oxigênio possui seis elétrons em sua camada de valência (última camada, camada L no caso do oxigênio).
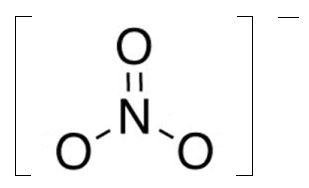
A combinação química entre os átomos de nitrogênio e oxigênio, na proporção de um átomo de nitrogênio para três de oxigênio, dá origem a uma importante espécie química iônica, chamada de nitrato. O nitrato apresenta carga elétrica negativa, em valência de 1 (um), sendo, portanto, um ânion monovalente (NO3-), conforme pode ser visto na figura abaixo:
Entre o átomo de nitrogênio e os átomos de oxigênio estão presentes ligações de natureza covalente (compartilhamento de elétrons entre átomos não-metálicos); uma dessas ligações é de natureza dupla e duas são de natureza simples. A partir da propriedade do átomo de oxigênio dar origem sempre a duas ligações químicas, restariam duas valências (uma para cada átomo) a serem preenchidas, sendo que uma delas é contrabalanceada pela propriedade do átomo de nitrogênio estabelecer três ligações. Assim, uma ligação a mais ao nitrogênio e uma ligação a menos em cada um dos dois oxigênios representados na parte inferior da molécula apresenta o nitrato como monovalente, aniônico.
Dessa forma, o ânion nitrato necessita doar este elétron para adquirir a estabilidade de um gás nobre (de acordo com a Regra do Octeto, oito elétrons na camada de valência conferem maior estabilidade a uma partícula). Assim, o NOX (número de oxidação) do nitrato é (-1), o qual expressa a sua tendência ao fazer uma ligação química. Isso ocorre predominantemente por uma ligação de natureza iônica, na qual o nitrato irá doar o seu elétron de valência a um metal, íon positivo, dando origem a um sal.
Entre os sais de maior importância envolvendo os nitratos pode-se destacar aqueles de metais alcalinos, como o nitrato de sódio (NaNO3), o nitrato de potássio (KNO3) e o nitrato de lítio (LiNO3). Já envolvendo metais alcalinos terrosos, tem-se o nitrato de cálcio e o nitrato de magnésio, de fórmulas moleculares, respectivamente, Ca(NO3)2 e Mg(NO3)2.
Referências:
FELTRE, Ricardo; Fundamentos da Química, vol. Único, Ed. Moderna, São Paulo/SP – 1990.
RUSSELL, John B.; Química Geral vol.1, São Paulo: Pearson Education do Brasil, Makron Books, 1994.
Texto originalmente publicado em https://www.infoescola.com/quimica/nitratos/