Enzimas são moléculas orgânicas de natureza proteica e agem nas reações químicas das células como catalisadoras, ou seja, aceleram a velocidade dos processos sem alterá-los. Geralmente são os catalisadores mais eficazes, por sua alta especificidade. Sua estrutura quaternária é quem determinará sua função, a que substrato ela se acoplará para acelerar determinada reação.
Nosso corpo é mantido vivo por uma série de reações químicas em cadeia, que chamamos de vias metabólicas, nas quais o produto de uma reação serve como reagente posteriormente. Todas as fases de uma via metabólica são mediadas por enzimas.
Quase todas as enzimas são de origem proteica, com exceção de algumas RNA catalíticas. Algumas funcionam sem adição de nenhuma outra molécula à sua cadeia polipeptídica, outras necessitam se ligarem a outro grupo, que chamamos de cofator, íons inorgânicos, ou a um grupo de moléculas orgânicas que chamamos de coenzima (ácido fólico, vitaminas, por exemplo). Em alguns casos, ela pode se ligar aos dois tipos e em outros podem sofrer alterações por processos como a glicosilação ou fosforilação.
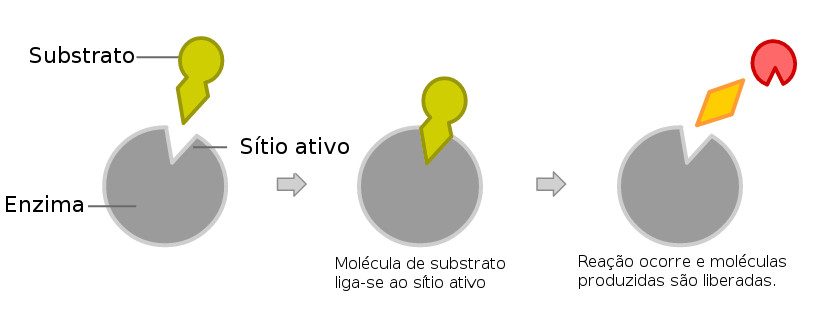
Esquema de funcionamento de uma enzima. Ilustração: Srhat / via Wikimedia Commons
Cada enzima é única para uma determinada reação. Para seu funcionamento eficaz, deve ter sua estrutura tridimensional conservada (terciária e quaternária). Ela possui uma região específica de ligação ao substrato chamada de sítio ativo, a conformação desta região forma um encaixe perfeito e único entre determinada enzima e um substrato, normalmente por ligações covalentes transitórias. Ao terminar a reação ela se solta do substrato e continua perfeita, em sua forma, para novas atividades. Como toda proteína, ela pode se desnaturar em algumas condições, como em altas temperaturas, variação extrema de pH, perdendo assim sua função. Como toda proteína, elas precisam de uma temperatura e pH ideal para serem ativas nas reações.
A enzima age na variação de entropia da reação, direcionando o substrato para que ele não colida de forma aleatória, aumentando a eficiência da reação.
Ela também diminui a energia de ativação, sem alterar o equilíbrio desta. A regulação da atividade enzimática pode ser controlada pela própria célula, na codificação de proteínas, como por ela mesma, variando de acordo com alguma molécula que se liga a ela.
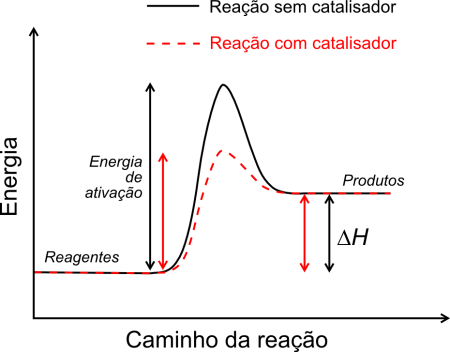
Energia de ativação. Ilustração: Bkell / Wikimedia Commons
No feedback negativo, o produto de uma via metabólica se liga a um sítio da enzima que está catalisando tal reação, inibindo-a. Cada vez que aumenta a quantidade do substrato, ele se liga à enzima e diminui a velocidade da reação. O inverso pode ocorrer, quando o produto se liga a um sítio da enzima estimulando-a, por conseguinte aumenta a velocidade da reação. Chamamos de feedback positivo. Esse tipo de interação muda a conformação da proteína e altera as ligações entre ela e o substrato. Quem sofre este tipo de alteração, podendo ter duas conformações e sua atividade modulada são as enzimas alostéricas. Existem outras formas da célula regular a atividade enzimática, como a fosforilação e a glicosilação de alguns aminoácidos.
As enzimas têm as mais diversas funções em nosso organismo e são essenciais para a vida. Estão no sistema digestivo, como a amilase (age na digestão do amido) e a pepsina (age na digestão de proteínas), ou a celulase (age na digestão de celulose) nos ruminantes. Atuam na contração muscular (miosina), como bombas iônicas nas membranas celulares, na transdução de sinais, entre centenas de outras funções. Estão presentes inclusive nos vírus – transcriptase reversa.
Leia também:
Referências:
Alberts, B; et al. Fundamentos da Biologia Celular. 2 ed. Porto Alegre: Artmed, 2006. 145-159 p.
Nelson, D. L; Cox, M. M. Princípios de Bioquímica de Lehninger. 5o ed. Porto Alegre: Artmed, 2011.183-233 p.
Texto originalmente publicado em https://www.infoescola.com/bioquimica/enzimas/