O hidróxido de potássio cuja fórmula molecular é o KOH pertence a classe das bases, sendo classificada como forte, e é também comumente chamado como potassa cáustica. É um sólido (temperatura ambiente) branco cristalino, bastante higroscópico, que pode ser comercializado na forma de pérola, micropérolas, pó, escamas, lentilhas ou ainda na forma de solução a 50% (m/v). Tem uma massa específica (densidade) de 2,044 g/ cm3, ponto de fusão de 360 °C (KOH 83%) e 380 °C (anidro) e ponto de ebulição de 1320 °C, sendo solúvel em água, alcoóis e glicerol. É considerada uma substância química muito perigosa por ser tóxica e corrosiva, reagindo exotermicamente (liberando calor) com água, ácido e solventes polares, liberando vapor sufocante e corrosivo e formando soluções fortemente alcalinas. Seja na forma sólida ou em solução pode causar sérias queimaduras quando em contato com pele ou olhos.
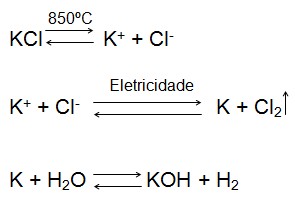
O KOH pode ser preparado de diferentes formas, entre elas pela eletrólise de cloreto de potássio (KCl). Primeiro ele é fundido a 850ºC e em seguida a ligação entre os átomos é quebrada pela passagem de corrente elétrica, sendo formado K e liberado gás cloro (Cl2). O K formado reage com água para formar KOH e gás hidrogênio (H2).
O KOH é utilizado em vários segmentos industriais, tais como matéria prima para fabricação medicamentos, fertilizantes, produtos de limpeza, entre outros. Além disso, é um reagente bastante em utilizados em laboratórios em ensaios de titulações, ajustes de pH de soluções e sínteses orgânicas e inorgânicas. Vamos ver alguns exemplos mais específicos.
É utilizado para fabricar sabões sólidos e detergentes, reagindo com ésteres, conforme representado a seguir.
KOH + RCO2R’ → RCO2K + R’OH
Nessa reação, o R e R’ são radicais orgânicos, e essa reação é uma hidrólise alcalina, também comumente conhecida como saponificação. Na reação é formado um sal orgânico de potássio e glicerol. Em comparação com os sabões formados com NaOH, os sabões de potássio são mais macios e mais solúveis em água. São utilizados na indústria cosmética para fabricar sabonetes, ao invés do NaOH, por ser menos agressivo a pele.
O KOH ataca compostos anidros, tais como SiO2 (presente na composição do vidro), por isso deve ser armazenado em frascos plásticos. Além disso, reage com CO2 formando bicarbonato.
KOH + CO2R → KHCO3
Por se uma base forte, soluções de KOH são capazes de desprotonar muitos ácidos. Dessa forma no laboratório são utilizados em titulações para quantificar ácidos, inclusive aqueles que não estão em meio aquoso, como por exemplo, em meio de etanol, em função de sua solubilidade neste composto.
Pode também ser utilizado com um precursor para a formação de sais potássio formado com os anions carbonato, cianeto, permanganato, fosfatos e vários silicatos. Esse preparo é feito através do tratamento dos óxidos com KOH. Uma aplicação importante é a produção de fosfato de potássio, que está presente nos fertilizantes.
Soluções aquosas de KOH são boas condutas, por isso servem como eletrólito em baterias alcalinas de níquel- cádmio, dióxido de manganês-zinco e níquel ferro.
Referencias
Atkins, P. W.; Jones, Loretta . Princípios de química: questionando a vida moderna e o meio ambiente. Volume único. 3. ed. Porto Alegre: Bookman, 2006
Tito e Canto. Química na Abordagem do Cotidiano. Volume único, parte A Química Orgânica. Editora Saraiva 2005.
Texto originalmente publicado em https://www.infoescola.com/compostos-quimicos/hidroxido-de-potassio/