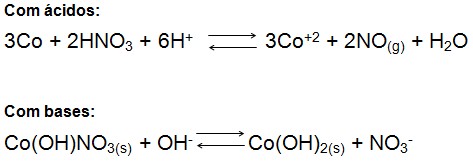O cobalto é um elemento de transição que pertence ao grupo VIII-B da classificação periódica, apresenta dureza acentuada e é quebradiço, apresenta cor cinza-aço se assemelhando ao ferro, possui número atômico 27 e massa atômica 58,93 u, propriedades discretamente magnéticas. As propriedades físicas do metal são variáves em decorrência da mistura alotróprica na qual este se apresenta comumente. Foi descoberto na antiguidade e isolado em 1735 pelo químico sueco Georg Brandt.
 É encontrado na natureza na forma de sulfoarsenieto de cobalto que que possui formula molecular CoAsS ou na forma de impureza associado a metais como Fe, Ag, Ni, Pb e Cu.
É encontrado na natureza na forma de sulfoarsenieto de cobalto que que possui formula molecular CoAsS ou na forma de impureza associado a metais como Fe, Ag, Ni, Pb e Cu.
O nome do metal é originado da mitologia germânica, que faz alusão a um duende chamado “Kobalt”, por que os mineiros acreditavam que o cobalto era um metal contaminante sem utilidade e figura do duende estar ligada a de seres malfazejos.
O cobalto é utilizado como componente ativo em formulações de secantes para pintura em óleo sobre tela, no refino de petróleo e outros processos químicos, é componente da liga do Alnico que é utilizado na fabricação de artefatos magnéticos. Forma liga com cromo e tungstênio que por sua vez é utilizado em objetos capazes de suportar altas temperaturas e ser mecanicamente resistente. O 60Co é usado no em radiografia e em radioterapia por ser uma potente fonte raios gama. Dissolve-se com facilidade em ácidos inorgânicos diluídos e forma hidróxidos insolúveis ou seja precipitados, em reação com bases fortes:
Informações Importantes sobre o Cobalto
- Símbolo: Co
- Estado de oxidação: Co+2 e Co+3
- Ponto de Fusão: 1490°C
- Ponto de Ebulição: 2927°C
- Configuração eletrônica: 1s², 2s², 2p6, 3s², 3p6, 4s², 3d7
Além das utilizações do metal citadas acima, existem outras importantes como a utilização em eletrodos, e a obtenção de seus sais como cloretos, sulfatos, nitratos e acetatos são utilizados para colorir o vidro de azul e na fabricação de tintas e de outros revestimentos metálico anti-corrosão. Os sais solúveis do metal são bactericidas altamente enérgicos que são utilizados na desinfecção de diversos produtos.
Bibliografia:
1- Russel, J. B. Química geral. São Paulo: Makron Books, 2004.
2 - Vogel, Arthur Israel, 1905-Química Analítica Qualitativa / Arthur I. Vogel ; [tradução por Antonio Gimeno da] 5. ed. rev. por G. Svehla.- São Paulo : Mestre Jou, 1981 .
3- Mahan, B. M. Química: um curso universitário. 4a ed. São Paulo: Edgard Blücher, 2003.
Texto originalmente publicado em https://www.infoescola.com/elementos-quimicos/cobalto/