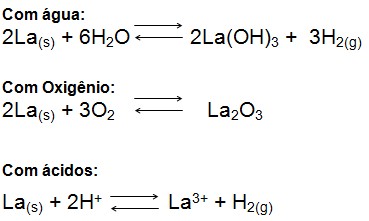O metal de transição interna lantânio (La) é branco prateado, maleável e dúctil, mole podendo ser cortado com uma faca, possui número atômico 57, massa atômica relativa 138,9055 u, sua configuração eletrônica é 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6 5d1 6s2. O lantânio foi descoberto pelo cientista Monsander, em 1839 em Estocolmo, a partir de um mineral chamado lantana presente em areia monazítica, a qual é uma de suas fontes mais abundantes. Seu nome é oriundo da palavra grega “lanthano” e significa aquele que está escondido. O lantânio possui ponto de fusão de 920ºC e ponto de ebulição de 3460ºC. É um metal de propriedades moderadamente tóxicas, porém é utilizado em muitos segmentos industriais com diversas finalidades.
O metal de transição interna lantânio (La) é branco prateado, maleável e dúctil, mole podendo ser cortado com uma faca, possui número atômico 57, massa atômica relativa 138,9055 u, sua configuração eletrônica é 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6 5d1 6s2. O lantânio foi descoberto pelo cientista Monsander, em 1839 em Estocolmo, a partir de um mineral chamado lantana presente em areia monazítica, a qual é uma de suas fontes mais abundantes. Seu nome é oriundo da palavra grega “lanthano” e significa aquele que está escondido. O lantânio possui ponto de fusão de 920ºC e ponto de ebulição de 3460ºC. É um metal de propriedades moderadamente tóxicas, porém é utilizado em muitos segmentos industriais com diversas finalidades.
Quimicamente o lantânio é um metal reativo, formando inúmeros compostos químicos com os mais diversos elementos; os principais são o nitrogênio, oxigênio e os halogênios. Forma também carbetos e hidretos, dentre outros compostos, porém esses são os mais comuns. Seu número de oxidação é +3, o lantânio reage com água formando hidróxido e liberando hidrogênio, quando exposto ao ar atmosférico rapidamente observa-se o aparecimento de manchas, em virtude da formação de óxido e carbonato do metal; reage exotermicamente com ácidos concentrados ou diluídos formando o respectivo sal e liberando hidrogênio. As reações do metal são mais bem observadas segundo as equações, respectivamente:
Em função de sua reatividade o lantânio é utilizado como catalisador no craqueamento do petróleo. Como componente absorvente de infravermelho na manufatura de vidros especiais e ópticos em forma de La2O3 e/ou La(NO)3, fabricação de pedras de isqueiro, artefatos de iluminação para projetores cinematográficos, eletrodos de baterias e eletrodos catódicos em função da sua alta emissão de elétrons , lentes telescópicas, na fabricação de ferro fundido e no tratamento de água. É adicionado ao aço no processo de fabricação, para aumento da resistência mecânica. Estudos têm observado o comportamento das interações entre lantânio e hidrogênio, em virtude da liga formada entre os elementos ser capaz de absorver cerca 400 vezes sua massa em volume desse mesmo gás.
É obtido comumente através da redução do LaF3 com Ca metálico, é encontrado juntamente com o nitrato de cério, não sendo, portanto encontrado em seu estado puro na natureza.
Leia também:
Bibliografia:
Mahan, B. M. Química: um curso universitário. 4a ed. São Paulo: Edgard Blücher, 2003.
SHRIVER, DUWARD; ATKINS, PETER. Química inorgânica - 4ª edição. Porto Alegre, Bookman, 2008.
LEE, J.D.. Química inorgânica não tão concisa – tradução da 4ª edição inglesa.São Paulo, Edgard Blücher, 1996.
Texto originalmente publicado em https://www.infoescola.com/elementos-quimicos/lantanio/