O protactínio (Pa) é um metal de transição interna (fazendo parte da série dos actinídeos) pertencente ao grupo 3 da tabela periódica. Possui número atômico igual a 91 (prótons e elétrons) e massa atômica ponderada igual a 231 u (essa massa é praticamente igual a do seu isótopo mais estável, com meia-vida igual a mais de 32500 anos).
 Nas condições ambiente, é sólido de aparência branco-prateada e brilhante (se exposto ao ar, essa coloração toma forma acinzentada por causa da formação de óxidos). É radioativo (núcleo não muito estável) e tóxico, justamente pela emissão de partículas alfa.
Nas condições ambiente, é sólido de aparência branco-prateada e brilhante (se exposto ao ar, essa coloração toma forma acinzentada por causa da formação de óxidos). É radioativo (núcleo não muito estável) e tóxico, justamente pela emissão de partículas alfa.
Conteúdo deste artigo
Propriedades físico-quimicas
Esse metal está na série de decaimento do urânio e, assim como seu predecessor, é instável. Sendo, então, uma considerável fonte de radiação alfa (núcleos de hélio).
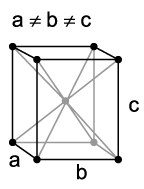 O retículo cristalino do protactínio assume forma ortorrômbica (átomos nos vértices de um paralelepípedo com um átomo central). Os estados de oxidação podem variar entre +2 e +5, sendo +4 e +5 os mais comuns. E, a eletronegatividade assume valor 1,5 (comum aos metais, mesmo os de transição) na escala Pauling.
O retículo cristalino do protactínio assume forma ortorrômbica (átomos nos vértices de um paralelepípedo com um átomo central). Os estados de oxidação podem variar entre +2 e +5, sendo +4 e +5 os mais comuns. E, a eletronegatividade assume valor 1,5 (comum aos metais, mesmo os de transição) na escala Pauling.
Possui densidade específica bastante elevada: 15370 Kg/m³, e os valores de ponto de fusão e ebulição giram em torno de 1570°C e 4030°C, respectivamente. Provando, então, que sua estrutura cristalina é forte o bastante para mantê-lo em estado de agregação sólido até em condições mais extremas.
O protactínio é um intermediário condutor de calor (conduz cerca de 40% menos que o ferro) e praticamente um mau condutor de eletricidade (conduz 50% menos que o ferro). A prata, o melhor condutor conhecido, é 12 vezes mais eficiente.
Ocorrência e Aplicações
Como o Pa-234 possui pequena meia-vida (menos de 7 horas), o protactínio sob forma natural é muito raro. Entretanto, o Pa-231 (isótopo mais estável) pode ser encontrado junto às reservas de tório, plutônio e urânio (já que é produto da fissão desses elementos).
No minério pechblenda, sua concentração média está em torno de 0,1 ppm. Mas em minérios de urânio, esse valor é um pouco maior: 0,34 ppm ou 340 mg a cada tonelada de minério.
As aplicações estão muito mais associadas aos ramos teóricos da física moderna do que na indústria ou cotidiano, uma vez que a 1,14K se comporta como supercondutor.
Ação Biológica
Por ser radioativo e tóxico ao organismo humano, deve-se manter exposição controlada seguindo uma série de regras de segurança, dentre elas o uso de roupa adequada, tempo de exposição o menor possível e evitar ao máximo contato direto.
Como qualquer outro radioisótopo, pode causar câncer e mutações no DNA das células.
Fontes:
http://nautilus.fis.uc.pt/st2.5/scenes-p/elem/e09100.html (acesso em 09/06/2011)
http://www.mspc.eng.br/quim1/quim1_091.shtml (acesso em 09/06/2011)
Texto originalmente publicado em https://www.infoescola.com/elementos-quimicos/protactinio/