Célula de combustível é uma célula eletroquímica capaz de gerar energia elétrica através de reações de oxirredução. Seu funcionamento baseia-se no mesmo princípio das pilhas e baterias, entretanto, na célula combustível, o fornecimento e consumo dos agentes redutores e oxidantes é contínuo, garantindo seu funcionamento por muito mais tempo, uma vez que não haverá esgotamento de seus reagentes e sua operação ininterrupta, já que não precisará “recarregar”.
Este processo de geração de energia tem alta eficiência, pois a conversão de energia química para elétrica se dá diretamente, evitando perdas, como ocorre nos processos a partir da queima de combustíveis fósseis, por exemplo, em que a energia química primeiramente é transformada em térmica, depois cinética e só então elétrica. Além disso, tem baixo impacto ambiental, pois emite poucos poluentes. Suas principais desvantagens são o alto custo de produção e a elevada pureza que o hidrogênio (combustível para o funcionamento da célula) deve ter para que não haja contaminação do catalisador.
Existem diversos tipos de células de combustível, pois, dependendo de onde deseja-se empregá-la, é necessário que se faça algumas alterações, a fim de atender aos requisitos do sistema elétrico do equipamento. Por exemplo, algumas máquinas exigem uma maior flexibilidade com relação a pureza do combustível, outras submeterão a célula de combustível a temperaturas elevadas, e assim por diante. Todas baseiam-se no mesmo princípio de funcionamento, em que eletrodos separados por um eletrólito são conectados, e no polo negativo (ânodo) ocorre a oxidação do hidrogênio e no polo positivo (cátodo) a redução do oxigênio.
Considerando uma célula de combustível que utiliza gás hidrogênio puro para funcionar, temos o seguinte esquema:
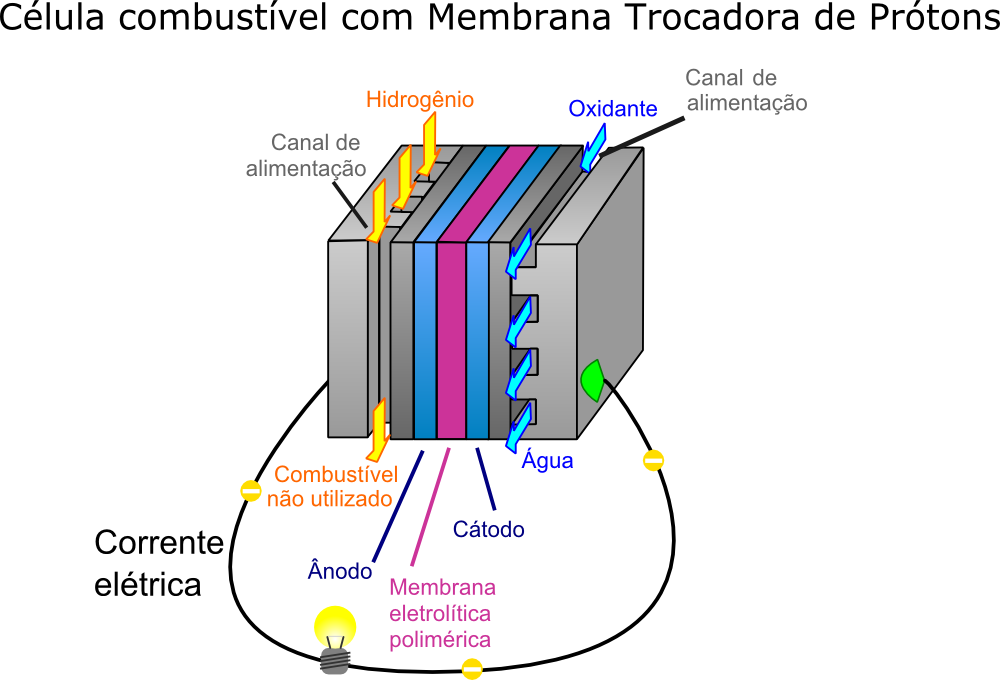
Célula de combustível. Ilustração: Jafet / via Wikimedia Commons (adaptado)
Em que o gás hidrogênio (H2) é bombeado para dentro da célula, no ânodo. Depois de atravessá-lo, o hidrogênio passa para o eletrólito, se dissolve e reage, formando H+ e liberando elétrons. Então, os elétrons são conduzidos até o cátodo pelo circuito externo, onde, com o auxílio de um catalisador, reduz o oxigênio (em geral, proveniente do bombeamento de ar). Assim, as reações que ocorrem são:
Ânodo (-): 2H2 → 4H+ + 4e-
Cátodo (+): O2 + 4H+ + 4e- → 2H2O
________________________________
Reação global: 2H2 + O2 → H2O
A diferença entre os tipos de células é o eletrólito selecionado. Também pode-se variar o combustível (substância que alimentará a célula com hidrogênios a serem oxidados) utilizado, que pode ser desde gás hidrogênio, H2, puro, até outros compostos ricos em hidrogênio, como hidrocarbonetos e álcoois. Porém, a classificação das células de combustível é feita com base no eletrólito usado. A tabela abaixo traz um resumo das principais classes de células, de acordo com seus eletrólitos e, consequentemente, a faixa de temperatura de funcionamento.
| Tipo (*) | Eletrólito | Faixa de temp. (°C) | Vantagens | Desvantagens | Aplicações |
| PEMFC | Polímero (H3O+) |
20-120 | Alta densidade de potência, operação flexível, mobilidade | Custo da membrana e catalisador, contaminação do catalisador com CO | Veículos automotores, espaçonaves, unidades estacionárias |
| PAFC | H3PO3 (H3O+) |
160-220 | Maior desenvolvimento tecnológico, tolerância a CO | Controle da porosidade do eletrodo, eficiência limitada pela corrosão | Unidades estacionárias, geração de calor |
| MCFC | Carbonatos fundidos (CO32-) |
550-660 | Tolerância a CO/CO2, eletrodos à base de Ni | Corrosão do cátodo, interface trifásica de difícil controle | Unidades estacionárias, cogeração de eletricidade / calor |
| SOFC | ZrO2 (zircônia) (O2-) |
850-1000 | Alta eficiência (cinética favorável), a reforma do combustível pode ser feita na célula | Problemas de materiais, expansão térmica | Unidades estacionárias, cogeração de eletricidade/calor |
(*) PEMFC (Proton Exchange Membran Fuel Cell), PAFC (Phosphoric Acid Fuel Cell), MCFC (Molten Carbonate Fuel Cell) e SOFC (Solid Oxid Fuel Cell). Fonte da tabela http://www.electrocell.com.br/oqueeacc_pt.htm
Em geral, utiliza-se mais de uma célula, em conjuntos que são chamados de Pilhas a Combustível, a fim de produzir correntes e cargas elétricas de acordo com a aplicação desejável.
Texto originalmente publicado em https://www.infoescola.com/eletroquimica/celula-de-combustivel/