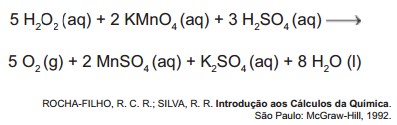
Concentração molar ou molaridade é a quantidade de soluto, em mol, dissolvidos num volume de solução em litros. O mol nada mais é que a quantidade de substâncias de um sistema que contém tantas unidades elementares quantas existem em átomos de carbono em 0, 012 kg de carbono-12. Esta unidade elementar deve ser especificada e pode ser um átomo, uma molécula, um íon, um elétron, um fóton etc., ou um grupo específico dessa unidade. Pela constante de Avogadro, esse número é igual a 6,02 x 10²³, aproximadamente. Muitas outras unidades de medida de concentração são utilizadas usualmente, como por exemplo, a percentagem de massa (ou erroneamente chamada de percentagem de peso), porém a mais usada e mais importante unidade de concentração é a molaridade.
Para calcular a concentração molar de uma substância é necessário ter em mãos uma tabela periódica, isto porque o cálculo envolve o número de massa de cada elemento que faz parte do soluto. A fórmula geral é:
M= Nº de mols do soluto / Nº de litros de solução
Assim, se 1 litro de solução foi preparado pela dissolução de 1 mol de cloreto de sódio, isto significa que esta é uma solução de cloreto de sódio de 1,0 mol\L.
1) Qual a molaridade de uma solução cujo volume é 0,250 L e contém 26,8 g de cloreto de cálcio, CaCl2?
Resolução:
Fórmula
Inicia-se o cálculo somando o número de massa (A) dos elementos do soluto, nesse caso, cálcio (Ca) e cloro (Cl):
Ca = 40,1
Cl = 35,5
40,1 + (2 x 35,5) = 111,1 (massa molar do CaCl2)
Para encontrar o número de mols de CaCl2 é preciso calcular:
1 mol de CaCl2 → 111,1 g de CaCl2
Nº de mols de CaCl2 → 26,8 g de CaCl2
Logo o número de mols de CaCl2 é 0,241 mol de CaCl2.
Aplicamos por fim, a fórmula (anteriormente citada) para encontrar a concentração molar da solução:
M = 0,241 mol / 0,250L = 0,964 mol/L
O valor da concentração molar é sempre expresso em mols por litro (mols/L), assim, se o volume da solução estiver em outra unidade como ml, cm³, dL, entre outros, é necessário converter em litro antes de realizar o cálculo por completo.
É importante ainda ter atenção e não confundir molaridadade com molalidade, visto que são termos parecidos graficamente. Molalidade é o número de mols de soluto existente em 1 kg do solvente, diferente da molaridade, já citada anteriormente. Devido a essa possível confusão, em muitas literaturas utiliza-se o termo concentração molar em vez de molaridade.
Referências bibliográficas:
MOORE, Walter J. Traduzido por: JORDAN, Ivo. Físico-química. Edgard Blucher: São Paulo, 1976. 4ª edição.
PILLA, Luiz. Físico-química. Livros Técnicos e Científicos Editora S.A.: Rio de Janeiro: 1979. 1ª edição.
Texto originalmente publicado em https://www.infoescola.com/fisico-quimica/molaridade/