O que caracteriza e define um estado físico da matéria são as forças atuantes em seu interior; coesão, a qual tende a aproximar as partículas, e repulsão, a qual tende a afastá-las. Quando a força de coesão supera a de repulsão, a substância se apresentará na fase de agregação chamada de sólido, quando as forças apresentarem a mesma intensidade, teremos um líquido, quando a de repulsão superar a de coesão, teremos então um gás. Cada um desses estados físicos distingue-se dos outros, entre outros fatores, por sua forma e volume. O estado sólido apresenta forma e volume constante, o líquido forma variável e volume constante, e o gasoso, forma e volume variáveis.
Na fase de agregação sólida, as partículas não apresentam liberdade de movimento, cabendo-lhes apenas movimentos de ordem vibracional, e a matéria terá maior densidade molecular. No estado líquido, as partículas podem literalmente “rolar” umas sobre as outras. Já na fase gasosa, as partículas terão ampla liberdade de movimento, e a matéria estará em sua fase de menor densidade molecular possível.
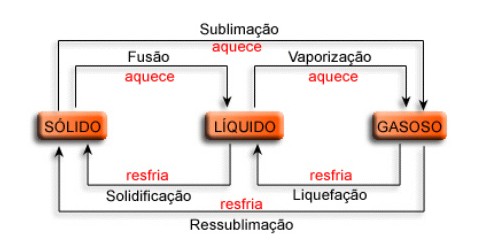
A matéria pode apresentar-se em qualquer estado físico, dependendo dos fatores pressão e temperatura. Assim, de modo geral, o aumento de temperatura e a redução de pressão favorecem o estado gasoso, e pode-se dizer que o inverso favorece ao estado sólido. As transformações de estado físico da matéria apresentam denominações características, como se pode ver abaixo:
a) FUSÃO: representa a passagem do estado sólido para o estado líquido. A temperatura na qual ocorre recebe o nome de Ponto de Fusão. Por exemplo, o derretimento de um cubo de gelo.
b) VAPORIZAÇÃO: representa a passagem do estado líquido para o estado gasoso. A temperatura na qual ocorre recebe o nome de Ponto de Ebulição. Uma vaporização pode ocorrer de três modos distintos:
- CALEFAÇÃO: passagem do estado líquido para o gasoso de modo muito rápido, quase instantâneo. Por exemplo, gotas de água sendo derramadas em uma chapa metálica aquecida.
- EBULIÇÃO: passagem do estado líquido para o estado gasoso por meio de aquecimento direto, envolvendo todo o líquido. Por exemplo, o aquecimento da água em uma panela ao fogão.
- EVAPORAÇÃO: passagem do estado líquido para o estado gasoso que envolve apenas a superfície do líquido. Por exemplo, a secagem de roupas em um varal.
c) LIQUEFAÇÃO ou CONDENSAÇÃO: representa a passagem do estado gasoso para o estado líquido. Por exemplo, a umidade externa de um frasco metálico ao ser exposto a uma temperatura relativamente elevada.
d) SOLIDIFICAÇÃO: representa a passagem do estado líquido para o estado sólido. Por exemplo, o congelamento da água em uma forma de gelo levada ao refrigerador.
e) SUBLIMAÇÃO: representa a passagem do estado sólido para o estado gasoso ou o processo inverso, sem passagem pelo estado líquido. Por exemplo, a sublimação do gás carbônico sólido, conhecido por gelo seco, em exposição à temperatura ambiente.
Referências:
FELTRE, Ricardo, Química Geral, Vol. I, Ed. Moderna, 6° Ed., São Paulo/SP, 2004.
Ilustração: http://www.profjoaoneto.com/quimicag/estadex.htm
Texto originalmente publicado em https://www.infoescola.com/fisico-quimica/mudancas-de-estado-fisico/