 Os compostos orgânicos são aqueles conhecidos por formarem longas e pesadas cadeias atômicas, sendo passíveis também de realizar reações químicas como as de Hidrogenação e Halogenação. Entretanto o que muitos alunos tem dúvida, é de como determinar a acidez ou alcalinidade de um composto orgânico.
Os compostos orgânicos são aqueles conhecidos por formarem longas e pesadas cadeias atômicas, sendo passíveis também de realizar reações químicas como as de Hidrogenação e Halogenação. Entretanto o que muitos alunos tem dúvida, é de como determinar a acidez ou alcalinidade de um composto orgânico.
Para realizarmos essa análise, primeiramente temos que ter em mente que toda a análise será feita com base na comparação entre os compostos, e os níveis de acidez ou alcalinidade tendem a ser muito baixos em comparação aos ácidos orgânicos e sintéticos.
Em segundo lugar, devemos trabalhar com a base conjugada da molécula. Tendo sempre em mente, que quanto mais instável a base menos ácida é a molécula. E Para determinarmos a instabilidade utilizamos a Regra do CREIO: Carga, Ressonância (Efeito Mesomérico), Efeito Indutivo e Orbitais.
Conteúdo deste artigo
Carga
Para isso vemos em qual átomo a carga se localiza:
- Átomos na mesma linha da Tabela Periódica
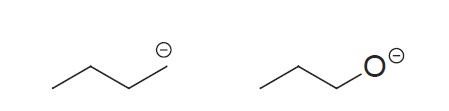
Se os átomos estão na mesma Linha da tabela, verificamos qual é o átomo de maior eletronegatividade, pois estes acomodam a carga negativa mais facilmente que os de menor eletronegatividade. Dica: Usar o FONClBrISCPH Metais. (Ordem decrescente de Eletronegatividade da Esquerda para Direita).
Neste Caso a molécula da direita ganha na estabilidade pelo Oxigênio ser melhor acomodador da carga negativa.
- Átomos na mesma coluna da tabela Periódica

Nesse caso devemos procurar pelo átomo de maior raio atômico, pois este acomodará melhor a carga negativa que um átomo de menor raio atômico. Neste caso o Enxofre ganha, por ter maior raio atômico.
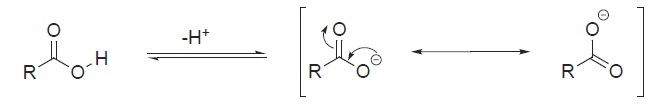
Ressonância
Muitos dos Compostos Orgânicos podem parecer ser estáticos, entretanto muitos dos que apresentam carga(ou não) podem ter formas híbridas instantâneas que são mais estáveis teoricamente que a forma original.

Uma das maneiras de se desenhar os híbridos é avaliar a carga e ter em mente que normalmente a carga negativa é atraída pela dupla ligação como no próximo exemplo:
Efeito Indutivo
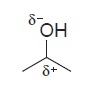 Esse tipo de efeito ocorre quando átomos de diferentes eletronegatividades se encontram ligados ou bem perto no composto. O átomo mais eletronegativo tem a tendência de trazer os elétrons para perto dele, criando assim um dipolo.
Esse tipo de efeito ocorre quando átomos de diferentes eletronegatividades se encontram ligados ou bem perto no composto. O átomo mais eletronegativo tem a tendência de trazer os elétrons para perto dele, criando assim um dipolo.
Esse dipolo pode ter um efeito estabilizante na molécula, pois ele “alivia” a carga excessiva em alguma ocasiões, acomodando melhor as cargas.
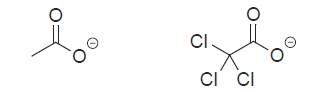
Neste caso, o grupo clorado da direita é mais estável.
Entretanto, em alguns casos ao invés de cadeias com radicais Cloro, podemos ter cadeias com radicais metila. Isso tem um grande impacto no efeito indutivo, tendo em mente que os grupos de alquilas são doadores de elétrons.
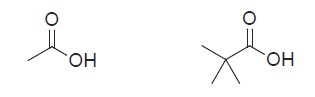
Sendo assim, a molécula da direita é mais instável.
Orbitais
Orbitais podem ser consideradas as prováveis áreas que o elétron pode ser encontrado em uma região ao redor nos núcleos atômicos. Essas áreas variam de acordo com o nível de energia do elétron, ou seja, a camada em que ele se encontra.
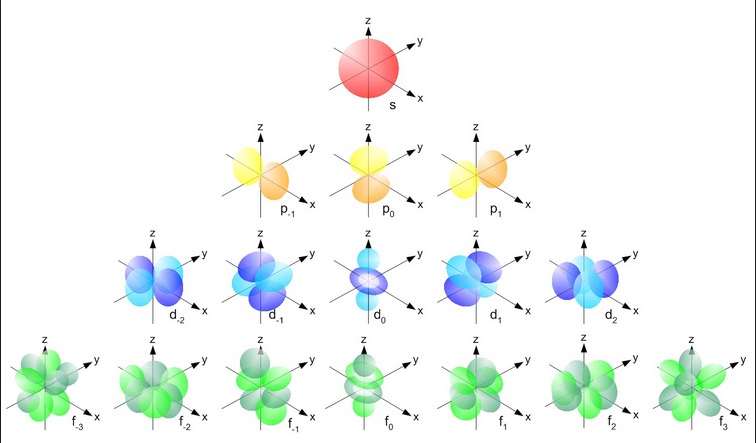
Para Sabermos qual é a Base de maior estabilidade com esse critério, definimos uma ordem de prioridade entre orbitais híbridos(ligações):
sp > sp² > sp³
Para determinar qual o estado de hibridização dos orbitais, podemos utilizar uma regra prática. Carbonos com ligações triplas são sp, com dupla são sp² e simples são sp³.
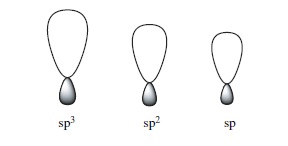
(Formatos dos Orbitais sp)
Por Lucas Sant’ Anna Pereira, Vice-Diretor do Departamento de Pesquisa e Desenvolvimento. Biotec Júnior – Empresa Júnior de Engenharia Biotecnológica da Unesp, Campus Assis.
Referências bibliográficas:
KLEIN, David. Organic Chemistry I as Second Language – 2ªEd. – Johns Hopkins University. Editora John Wiley & Sons, Inc.2008
ATKINS, Peter. LORETTA, Jones. Princípios de química: questionando a vida moderna e o meio ambiente; tradução Ricardo Bicca de Alencastro. – 3ª Ed. – Porto Alegre: Bookman, 2006. 968 páginas.
Texto originalmente publicado em https://www.infoescola.com/quimica/acidez-em-compostos-organicos/