A cinética química estuda a velocidade que as reações ocorrem e os fatores que podem modificá-la. A teoria que rege o estudo da cinética é a teoria das Colisões. Essa teoria explica que para que uma reação inicie ela precisa de energia a qual é adquirida através de colisões entre átomos ou moléculas em um sistema. Essas colisões precisam ser efetivas e para serem efetivas devem ser frontais. Quanto mais concentrado for o meio mais colisões ocorrerão e consequentemente mais energia será obtida, e o inverso também é válido. A quantidade de energia necessária para que uma reação inicie é chamada de energia de ativação. A energia de ativação é definida quimicamente como o mínimo de energia necessária para iniciar uma reação.
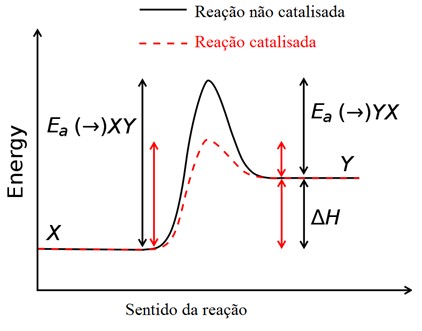
Abaixo apresentamos um gráfico de uma reação química:
No gráfico percebemos que a energia de ativação é o caminho dos reagentes até o ponto mais alto do gráfico, que é o complexo ativado. Este ponto da reação é o mais energético e é o momento reacional onde reagentes e produtos coexistem. Após esse ponto ocorre a formação dos produtos. Devemos entender que quanto maior for o caminho dos reagentes até a formação do complexo ativado (a energia de ativação) mais tempo a reação leva para ocorrer. Alguns fatores que podem influenciar a velocidade de uma reação são: a temperatura, a pressão, a concentração, a superfície de contato e por fim, o catalisador e o inibidor.
- Temperatura: Um aumento na temperatura favorece o aumento na velocidade da reação.
- Pressão: Um aumento na pressão aumenta a velocidade reacional.
- Concentração: Um aumento na concentração faz com que aumente a velocidade da reação devido ao aumento de colisões entre os reagentes.
- Superfície de contato: possui efeito quando um reagente é sólido e o outro é líquido. Quanto menor for o tamanho da partícula sólida mais rápida será a reação química.
- Catalisador: é uma substância que altera a velocidade de uma reação química (aumenta) sem interferir na formação dos produtos ou mesmo ser consumido na reação.
- Inibidor: Funciona como o catalisador mas tem o efeito de inibir a velocidade de uma reação, ou seja, torná-la mais lenta.
Os catalisadores são muito utilizados na indústria principalmente porque eles têm por função acelerar a reação sem alterar a formação, ou a quantidade formada de produtos. Quando se utiliza o catalisador a reação tem seu caminho reacional diminuído, ou seja, diminui a energia de ativação (linha vermelha no gráfico), fazendo com que a reação se torne mais rápida. Quando se utiliza o inibidor ocorre o contrário, o caminho reacional aumenta e a reação torna-se mais lenta. Nas reações endotérmicas, que são aquelas que absorvem energia, a energia de ativação é maior do que nas reações exotérmicas, que são aquelas que liberam energia. Um exemplo de catalisador biológico são as enzimas presentes em nosso organismo que fazem com que os processos corporais se tornem mais eficientes.
Texto originalmente publicado em https://www.infoescola.com/quimica/cinetica/