Quando um átomo isolado, em seu estado fundamental, absorve energia, seu elétron pode de deslocar de um nível energético quantizado para outro. Se a energia adicionada for suficiente, o elétron poderá então ser removido do átomo, dando origem a um íon positivo. “O elétron mais facilmente removível é aquele menos firmemente preso ao núcleo, e de mais alta energia”1.
“O termo potencial de ionização é algumas vezes empregado para representar a energia do processo de ionização e é expresso em unidades de eV . átomo-1, sendo 1 eV.átomo–1 equivalente a 96,4869 KJ mol-1”2.
A ionização é um processo de formação de um íon positivo pela remoção de um ou mais elétrons. Então, a energia de ionização pode ser definida como a energia mínima necessária para remover o primeiro elétron de um átomo, em estado fundamental. (O termo fundamental expressa neste caso o estado gasoso, uma vez que o átomo está livre de influências de átomos vizinhos; está isolado.) Então, a energia de ionização é a energia necessária para provocar o seguinte processo:
X(g) → X+(g) + 1 elétron
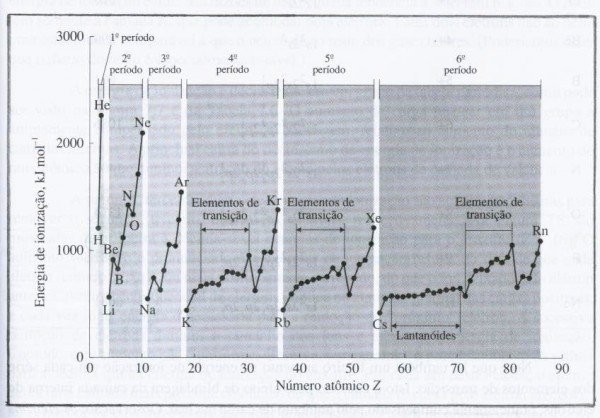
A maneira pela qual a energia de ionização varia com o número atômico é uma vez mais uma ilustração da lei de periodicidade química. A Figura 1 mostra essa variação para os primeiros seis períodos. De modo geral, como a carga nuclear aumenta através de um período e os elétrons periféricos são mais fortemente atraídos pelo núcleo e dessa forma presos ao átomo, mais energia é necessária para remoção de um elétron do átomo.
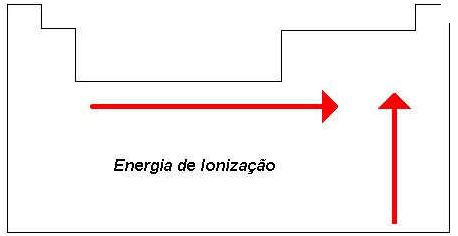
A medida em que aumenta o tamanho relativo do átomo, aumenta também a facilidade para remoção de um elétron de valência (periférico). Portanto, quanto maior for o tamanho do átomo, menor será a energia de ionização. E como o átomo aumenta em tamanho na tabela periódica de cima para baixo, a energia de ionização aumentará de baixo para cima.
Como mostrou-se, o tamanho de um átomo ao longo de um período aumenta da direita para a esquerda, portanto, a atração do núcleo sobre os elétrons de valência aumentará da esquerda para a direita. Esquematicamente, a Figura 2 mostra o comportamento desta propriedade na tabela periódica.
A segunda, terceira, quarta, etc. energias de ionização são aquelas necessárias para remover o segundo, terceiro, quarto, etc. elétrons, respectivamente. “Ocorre então um aumento sucessivo e pronunciado das energias de ionização sequenciais, e isto resulta do fato de que cada elétron retirado deixa o íon mais positivamente carregado do que o íon deixado pelo elétron anterior. Portanto, a remoção sequencial de elétrons implica no aumento gradual das cargas positivas, e cada vez mais energia é necessária para remoção do “próximo elétron”. A sucessiva remoção de elétrons diminui o tamanho dos íons e consequentemente aumenta a energia de ionização”4.
Referências:
1. EPSTEIN, Lawrence M.; ROSENBERG, Jerome l.; Química Geral, (Coleção Schaum), Porto Alegre: Bookman, 2003.
2. JONES, Chris J.; A Química dos Elementos dos Blocos d e f, Sociedade Brasileira de Química, Bookman, São Paulo/SP – 2002.
3. RUSSELL, John B.; Química Geral vol.1, São Paulo: Pearson Education do Brasil, Makron Books, 1994.
4. MAHAN, Bruce M.; MYERS, Rollie J.; Química: um curso universitário, Ed. Edgard Blucher LTDA, São Paulo/SP – 2002.
Texto originalmente publicado em https://www.infoescola.com/quimica/energia-de-ionizacao/