Toda matéria é formada por partículas menores (átomos e moléculas) que interagem entre si, dando à matéria certas características. Uma delas é a propriedade física chamada de estado físico da matéria, estado de agregação, ou ainda, fase. Essa propriedade diz respeito à configuração macroscópica que os objetos apresentam e está relacionada com a velocidade do movimento (a agitação) das partículas que os constituem.
A velocidade de movimento, isto é, a energia cinética das partículas, interfere no estado físico da substância, pois quanto maior a média das energias, mais agitadas estarão as partículas e, consequentemente, mais afastadas umas das outras elas se encontrarão. A água, por exemplo, quando está em seu estado sólido (gelo), tem suas moléculas muito próximas umas das outras, com uma média de energia cinética baixa; já em seu estado gasoso (vapor), as moléculas estão bastante dispersas ou separadas, graças ao alto grau de agitação delas. Atualmente, são conhecidos 7 estados físicos e há quem defenda ainda mais tipos, porém, os mais consolidados e importantes para nossa experiência cotidiana são três: sólido, líquido e gasoso.
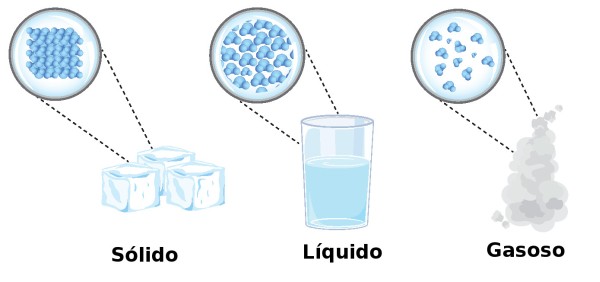
Os três estados da matéria. Ilustração: snapgalleria / Shutterstock.com (adaptado)
É possível que uma substância passe de um estado ao outro, sem contudo, alterar sua natureza química, por isso essa mudança é chamada de transformação física. Os principais fatores que a influenciam são pressão e temperatura. Por exemplo, quando cozinhamos, a água líquida vira vapor (água gasosa) devido ao aumento da temperatura, uma vez que se fornece energia em forma de calor à substância, aumentando seu grau de agitação. Entretanto, a substância continua sendo água e suas moléculas continuam intactas, apenas encontram-se mais afastadas umas das outras.

Ouro em estado sólido. Foto: Sashkin / Shutterstock.com

Cilindros de gás. Foto: albund / Shutterstock.com

Estado líquido. Foto: Edler von Rabenstein / Shutterstock.com
Ainda que a pressão e a temperatura possam alterar o estado físico, somente elas não determinam a fase da matéria, já que duas substâncias distintas podem se apresentar em diferentes estados, mesmo que estejam sob mesmas condições de temperatura e pressão. Isso porque esta propriedade física também depende da natureza dos compostos, mais precisamente, às forças de coesão (atração) e de repulsão (afastamento) das partículas que os constituem.
Como já mencionado, os estados físicos comumente estudados são sólido, líquido e gasoso. A seguir é apresentada uma tabela comparativa entre os três, bem como características micro e macroscópicas e exemplos de cada um.
| Sólido | Líquido | Gasoso | |
| Características microscópicas | Predominam as forças de coesão, e por isso, suas partículas encontram-se bastante próximas e organizadas (compactadas). | As forças de atração são menos intensas, o que permite maior movimento das partículas e menor organização. | Predominam as forças de repulsão, portanto, as partículas possuem grande liberdade de movimento, ficam distantes umas das outras e bastante desorganizadas. |
| Características macroscópicas | Tem forma e volumes definidos, isto é, não variam. Não sofre compressão. | Possui volume definido (constante), porém, forma variável, já que assume o formato do recipiente que o contém. Sofre pouca compressão. | Não tem forma, nem volume definidos, uma vez que assumirá o formato do recipiente e ocupará todo o espaço fornecido. Sofre compressão e expansão facilmente. |
| Exemplos | Caneta, armário de madeira, camiseta, Lua, etc. | Suco, mercúrio do termômetro, suor, água do mar, etc. | Ar atmosférico, gás Hélio, vapor, gás lacrimogêneo, etc. |
Texto originalmente publicado em https://www.infoescola.com/quimica/estados-fisicos-da-materia/