Éteres são compostos que possuem um átomo de oxigênio ligado a dois átomos de carbono pertencentes a um radical orgânico. Possuem fórmula geral R – O – R, R – O – Ar, ou Ar – O – Ar, onde Ar significa um anel aromático ou benzeno.
Os éteres são muito diversos, podendo ser gasosos, líquidos ou sólidos. São gasosos até três átomos de carbonos. São incolores e pouco solúveis em água. Por não possuírem ligações por pontes de hidrogênio, são bem mais voláteis que os alcoóis de mesma massa molecular. Seus pontos de fusão e ebulição são, dessa forma, mais baixos que os dos alcoóis de massa molecular próxima.
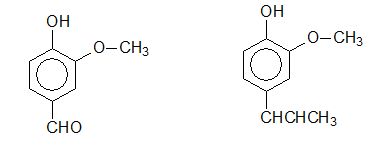
Em geral, os éteres são obtidos sinteticamente, mas diversos éteres alquilarílicos encontram-se na natureza, nos óleos essenciais de várias plantas, como, por exemplo, a essência da baunilha e a essência de noz-moscada, mostradas, respectivamente, abaixo.
Os éteres São utilizados em sínteses de diversos compostos orgânicos, perfumaria, produção de tintas, solventes orgânicos.
O metoximetano e o metoxietano são gases nas condições normais de temperatura e pressão. Do etoxietano em diante são líquidos incolores de odor agradável. Os demais são sólidos.
São pouco solúveis em água, mas são muito utilizados como solventes de compostos apolares.
Possuem pontos de fusão e ebulição baixos quando comparados com seus isômeros de função, já que suas ligações intermoleculares são do tipo Forças de Van der Waals. Em geral, são menos densos que a água. O éter mais importante é o etoxietano, também chamado éter etílico, éter comum ou éter sulfúrico (porque é preparado a partir do álcool etílico com ácido sulfúrico concentrado a 140°C). Esse composto é utilizado como anestésico, solvente de compostos apolares, como extrator de óleos, gorduras e essências.
A obtenção do etoxietano foi observada pelo odor característico desprendido na reação de obtenção do eteno a partir do álcool etílico e ácido sulfúrico concentrado, quando ainda em temperatura mais baixa.
Abaixo descreve-se duas técnicas experimentais simples envolvendo o etoxietano, éter mais importante. Ambas podem ser executadas no laboratório de química de uma escola tradicional, sem necessidade de maiores sofisticações.
a) Volatilidade.
- Colocar na palma da mão uma gota de etanol e uma de etoxietano.
- Observar qual é o mais volátil.
- Medir temperatura de ebulição do etoxietano em aquecimento sob banho-maria.
b) Solubilidade em água.
- Colocar em três tubos de ensaio, respectivamente, 3mL de água destilada, 3mL de água destilada e 3mL de tetracloreto de carbono (CCl4).
- Ao primeiro adicionar 2 gotas de etoxietano, ao segundo e ao terceiro 2mL.
- Observar e justificar observações.
Referências:
SARDELLA, Antônio; MATEUS, Edegar; Curso de Química: química geral, Ed. Ática, São Paulo/SP – 1995.
MAHAN, Bruce M.; MYERS, Rollie J.; Química: um curso universitário, Ed. Edgard Blucher LTDA, São Paulo/SP – 2002.
Texto originalmente publicado em https://www.infoescola.com/quimica/experimentacao-com-a-funcao-organica-eter/