No ensaio conhecido como teste da chama, ocorrem interações atômicas através dos níveis e subníveis de energia quantizada de um átomo de um cátion metálico. Considerando-se o átomo de potássio, por exemplo, onde o elétron 4s1 é o mais externo, este elétron pode ser elevado para um subnível mais externo quando sob uma fonte intensa de energia (calor), chegando a 4p1, ocorrendo assim a sua excitação eletrônica. O elétron excitado, entretanto, apresenta tendência a retornar ao seu estado natural de 4s1, emitindo um quantum de energia (fóton) quando em seu retorno ao subnível de menor energia, que é uma quantidade de energia bem definida e única para cada cátion metálico, a qual pode servir para a sua identificação. No caso do cátion potássio, obtém-se uma coloração violeta da chama, sendo esta a coloração capaz de identificar este cátion, uma vez que é devido à diferença de energia entre os subníveis 4s e 4p para o átomo em questão.
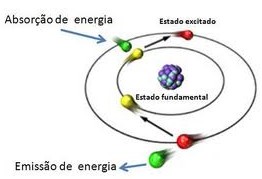
A figura mostrada abaixo resume este processo. A absorção de energia promove os elétrons periféricos para um estado de mais alta energia (estado excitado), no momento em que cessa essa adição de energia, esses elétrons retornam à sua posição de origem, devolvendo a energia recebida sob a forma de luz (que nós percebemos como cor).
Em 1913, Niels Bohr, após uma série de experimentações e ensaios matemáticos, elaborou três postulados muito importantes para a compreensão que temos hoje a respeito da estrutura atômica.
- Enquanto o elétron está numa determinada orbita, sua energia é constante.
- Se o elétron receber energia suficiente, ele saltará a uma orbita com energia superior.
- Ao retornar a sua orbita de origem, o elétron emite, na forma de ondas eletromagnéticas, a mesma quantidade de energia absorvida.
Com relação ao teste da chama, os postulados de Bohr prestam-se muito bem ao se buscar uma explicação às observações. A queima de um sal metálico implica na promoção de elétrons, cujo retorno é revelado pela emissão de luz. Assim, um elétron pode passar de um nível para outro de maior energia, desde que absorva energia externa (ultravioleta, luz visível, infravermelho etc.). Quando isso acontece, dizemos que o elétron foi excitado e que ocorreu uma transição eletrônica. Já a transição de retorno deste elétron ao nível inicial se faz acompanhar pela liberação da energia na forma de ondas eletromagnéticas, como, por exemplo, a luz visível, que é percebida por nossos sentidos como uma coloração.
Referências:
FELTRE, Ricardo, Química Orgânica, Ed. Moderna, 6ª Edição, São Paulo, 2004.
PERUZZO, Francisco; CANTO, Eduardo Leite, Química na abordagem do Cotidiano, Ed. Moderna, 3ª Edição, São Paulo, 2003.
ATKINS, Peter; JONES, Loreta; Princípios de Química: questionando a vida moderna e o meio ambiente, Porto Alegre: Bookman, 2001.
Ilustração: http://portaldoprofessor.mec.gov.br/storage/recursos/10951/TesteDeChama/Teste_de_Chama.html
Texto originalmente publicado em https://www.infoescola.com/quimica/explicacao-em-bohr-para-o-teste-da-chama/