Os compostos inorgânicos são caracterizados por possuírem dois ou mais elementos químicos em sua composição e por não conterem cadeias carbônicas, ou seja, átomos do elemento carbono formando ligações entre si. Estes compostos possuem como característica a formação de ligações iônicas ou covalentes que são capazes de formar íons. Para facilitar o entendimento, dividimos os compostos pertencentes às funções inorgânicas em grupos, de acordo com sua composição química e interação com a água. Os principais grupos inorgânicos são os ácidos, as bases, os sais e os óxidos.
Conteúdo deste artigo
Dissociação iônica
Para facilitar o entendimento, vamos abordar a dissociação iônica, onde há a “quebra” de uma molécula iônica quando em contato com a água, de acordo com a sua solubilidade em meio aquoso.
Quando um composto iônico entra em contato com a água, tende a separar os íons através do rompimento do retículo cristalino, desse modo, os íons podem movimentar-se livremente na solução aquosa, como podemos verificar na reação de dissolução do sal comum em água:
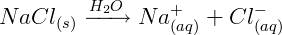
Ionização
A ionização ocorre com substâncias formadas por ligações covalentes, que, quando solúveis em água, originam íons, como podemos observar na ionização do Ácido Clorídrico (HCl):
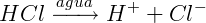
Ácidos e Bases
Há duas principais propostas sobre a definição de ácidos e bases, que são as mais utilizadas e aceitas atualmente: Definição de Arrhenius e Definição de Brönsted e Lowry.
Definição de Ácidos e Bases segundo Arrhenius (1887)
De acordo com a definição do físico-químico Svante August Arrhenius (1859 – 1927), ácidos são substâncias que, em solução aquosa, produzem íons de hidrônio (H3O+), ou simplificadamente, hidrogênio (H+), e ânions, que variam de acordo com a composição do ácido. Bases, por sua vez, são substâncias que, em solução aquosa, produzem cátions que variam de acordo com a composição da base em questão e ânions hidróxido (OH-).
Exemplos:
Ionização do Ácido Nítrico (HNO3):
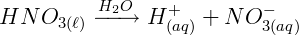
Ionização do Hidróxido de Sódio (NaOH):
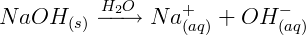
Definição de Ácidos e Bases segundo Brönsted e Lowry (1923)
Diversas reações químicas ocorrem sem a necessidade da presença de água, o que torna a proposta de Arrhenius inviável, e, visando solucionar esta questão, os químicos Johannes Nicolaus Brönsted (1879 – 1936) e Thomas Martin Lowry (1879 – 1949), propuseram que ácidos são toda e qualquer espécie química capaz de doar um próton H+, e bases são toda e qualquer espécie química capaz de aceitar ou receber um próton H+.
Exemplo:
Se deixarmos um frasco contendo ácido clorídrico aberto próximo à um frasco contendo amônia, é possível afirmar a definição de Brönsted e Lowry, pois há a reação entre os dois compostos, com formação de Cloreto de Amônio, sem a presença de água para que ocorra a reação:
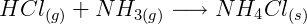
Nesta reação, o ácido clorídrico é doador de próton H+, e a amônia é receptora de próton H+.
Características de Ácidos e Bases
Os ácidos possuem sabor azedo, reagem com alguns metais liberando gás hidrogênio, podem ser fortes, semi-fortes ou fracos, possuem pH de 0 a 6 na escala de potencial hidrogeniônico, são condutores de eletricidade em meio aquoso, podem causar queimaduras graves se entrarem em contato com a pele, alteram a coloração dos indicadores e reagem com bases formando como produtos sal e água.
As bases possuem sabor amargo e adstringente, são corrosivos em contato com a pele, podem ser fortes ou fracas, possui sensação tátil escorregadia, neutralizam ácidos, são bons condutores de eletricidade em meio aquoso, possuem pH de 8 a 14 na escala de potencial hidrogeniônico e alteram a coloração de indicadores de ácido-base.
Sais
Os sais, assim como ácidos e bases, liberam íons ao entrar em contato com a água. A definição dos sais considerada atualmente é de Arrhenius, que classifica os sais como compostos capazes de dissociar-se em presença de água, liberando íons mesmo em pequena quantidade, onde, o cátion liberado é diferente de H+ ou H3O+, e o ânion liberado é diferente de OH-.
Alguns sais em contato com meio aquoso liberam os íons mencionados acima (H+ ou H3O+ e OH-), contudo, estes não podem ser os únicos íons liberados.
A maneira mais simples de produzir um sal é através da reação de neutralização um ácido com uma base:
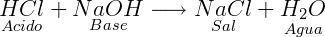
Características dos sais
Os sais possuem sabor salgado, reagem com ácidos, bases, outros sais e com metais, são condutores de eletricidade em solução aquosa, em temperatura ambiente são encontrados no estado sólido, alguns deles possuem grande capacidade de formar cristais com moléculas de água, formando os sais hidratados.
Óxidos
Quase todos os elementos químicos existentes, com raras exceções, possuem facilidade de ligar-se ao elemento Oxigênio formando óxidos. Toda espécie binária (que possui dois elementos distintos), que possui o oxigênio como elemento mais eletronegativo é considerado um óxido. Compostos formados entre o oxigênio e o flúor não são considerados óxidos, pois o flúor é mais eletronegativo que o oxigênio. Há óxidos conhecidos que contém gases nobres em sua composição, por exemplo, o XeO e o XeO4, contudo, esses óxidos são formados em condições especiais, considerando que os elementos da família dos gases nobres são estáveis. A fórmula geral dos óxidos é representada da seguinte maneira:
ExOy
O oxigênio é altamente reativo, desse modo, podemos encontrar óxidos formados por metais e ametais. Os óxidos metálicos costumam possuir caráter iônico, já os óxidos formados por ametais possuem normalmente caráter covalente.
Devido à grande diversidade de óxidos que podem ser formados, podemos classificar os mesmos de acordo com as características dos elementos que se ligam ao Oxigênio para formar o óxido. Eles podem ser: ácidos, básicos, neutros e anfóteros.
- Óxidos ácidos: são óxidos que quando dissolvidos em água, reagem formando um ácido.
- Óxidos básicos: são óxidos que quando dissolvidos em água, reagem formando uma base.
- Óxidos neutros: não reagem com presença de água, ácidos ou bases.
- Óxidos anfóteros: são óxidos os quais o comportamento varia de acordo com a substância a qual forem adicionados.
Leia também:
- Propriedades experimentais das funções inorgânicas
- Classificação de óxidos inorgânicos
- Classificação de ácidos inorgânicos
- Classificação de sais inorgânicos
- Classificação de bases inorgânicas
- Química inorgânica
- Funções orgânicas
Referências:
FONSECA, M. R. M da. Química 1. 1. ed. São Paulo: Ática, 2013.
BIANCHI, J. C. de A. Universo da Química: Ensino Médio: Volume único. 1. Ed. São Paulo: FTD, 2005.
SANTOS, W. L. P.dos.; MOL, G. de S. Química Cidadã: Volume 1: Ensino Médio. 2. ed. São Paulo: AJS, 2013.
BOSQUILHA, G. Minimanual de Química: Teoria e Pratica. 2. Ed. rev. São Paulo: Rideel, 2003.
Texto originalmente publicado em https://www.infoescola.com/quimica/funcoes-inorganicas/