A química dos compostos carbônicos é bastante extensa, onde determinados compostos são agrupados por apresentarem características afins, como é o caso dos hidrocarbonetos (formados somente por carbono e hidrogênio). Dentre os hidrocarbonetos, apenas alcanos e cicloalcanos não possuem insaturações, sendo todas as outras classes detentoras de ao menos um par de ligações duplas, ou seja, são compostos insaturados. Na tabela a seguir temos hidrocarbonetos contendo seis átomos de carbono em sua cadeia principal.
Tabela 1. Classes de hidrocarbonetos – massa e fórmulas.
| Hidrocarboneto | Nomenclatura | Massa molar (g/mol) | Fórmula estrutural/molecular |
| Alcano | Hexano | 86,18 | 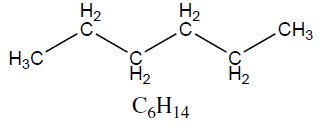 |
| Alceno | Hex-2-eno | 84,16 | 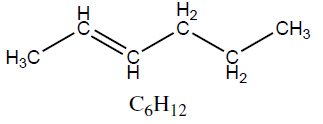 |
| Alcino | Hex-2-ino | 82,14 | 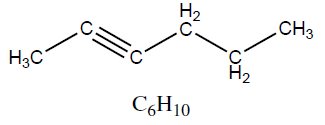 |
| Alcadieno | Hex-2,4-dieno | 82,14 | 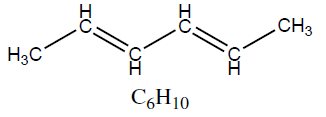 |
| Cicloalcanos | Ciclohexano | 84,16 | 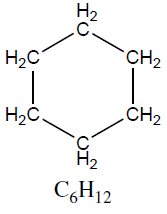 |
| Cicloalcenos | Ciclohex-1-eno | 82,14 | 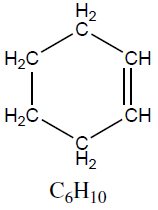 |
| Hidrocarbonetos aromáticos | Benzeno | 78,11 | 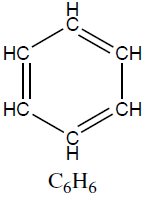 |
Oriundos de fontes naturais, como o petróleo, o carvão mineral e o xisto e em alguns casos, do óleo de animais e plantas, os hidrocarbonetos são importantes em nossa sociedade por servir como combustível, insumos industriais de uma série de produtos (gêneros alimentícios, plásticos, borrachas, óleos lubrificantes, etc.). Compostos que pertencem a outras funções orgânicas também apresentam insaturações, como a cafeína, a riboflavina ou vitamina B2, fármacos, corantes, etc.
As insaturações são importantes para as moléculas orgânicas, pois se tratam de “caminhos” por onde reações podem ocorrer. Os alcanos, hidrocarbonetos saturados, que também recebem o nome de parafinas, são denominados desta forma por serem pouco reativos (do latim, parum affinis = pequena ou pouca afinidade). Isso faz com que as reações realizadas com alcanos necessitem de condições de temperatura e pressão, na maioria dos casos, bastante altas.
Alcanos podem sofrer halogenação (reação com halogênios), originando haletos saturados. Os de grande massa molecular sofrem pirólise ou craqueamento (quebra pelo fornecimento de calor em atmosfera isenta de oxigênio). Alcanos gasosos podem, em condições agressivas, ser convertidos em seus correlatos alcenos, através da reação conhecida como de-hidrogenação catalítica.
Alcenos e alcinos são mais reativos que os alcanos, e podem ser utilizados como ponto de partida para a síntese de moléculas importantes.
Alcadienos são importantes na síntese de polímeros e elastômeros, sendo utilizados também na preparação de furanos e cicloalcenos, além de reagir com halogênios e hidrogênio. Os carotenoides, da classe dos polienos (alcadienos com muitas ligações duplas) são macromoléculas de importante ação biológica, estando presente em diversos vegetais (licopeno, nos tomates; betacaroteno, nas cenouras) e servindo como fonte de vitaminas, que é o caso do beta caroteno (vitamina A).
Cicloalcanos com três e quatro carbonos (ciclopropano e ciclobutano) são bastante reativos, em parte pela alta tensão apresentada em seus anéis cíclicos (Teoria de Sasche-Mohr). O ciclopropano é um anestésico utilizado na medicina por não apresentar efeitos toxicológicos agudos (acidentes) quando ministrado em proporção correta.
Um cicloalceno importante, como o pineno, compõe o óleo de terebentina, utilizado para diluir pigmentos e limpar pincéis. E por apresentar insaturação em sua estrutura, o mesmo pode sofrer reações como o que ocorre com os alcenos.
Hidrocarbonetos aromáticos, como o benzeno e os alquilbenzenos são compostos importantes na indústria química. Embora apresentem um nível elevado de insaturações, estes compostos são pouco reativos, sendo o fenômeno da ressonância de suas duplas ligações a justificativa desta baixa reatividade. Hidrocarbonetos aromáticos geralmente sofrem substituição de um de seus hidrogênios, mantendo o anel aromático intacto e, por conseguinte, seu caráter aromático aos produtos destas reações. O benzeno é perigoso agente cancerígeno, encontrado em uma série de substâncias químicas do cotidiano (refrigerantes, colas, tintas e vernizes, etc.).
Referências:
CAMPOS, M.M; AMARAL, L.F.P. [et.al]. Fundamentos de Química orgânica. São Paulo: Edgard Blücher, 1980. p. 56 – 154.
LISBOA, J. C. F. Química, 3º ano: ensino médio. 1ª Ed. – São Paulo: Edições SM, 2010. (coleção Ser protagonista). p.57 – 58.
Texto originalmente publicado em https://www.infoescola.com/quimica/insaturacao/