A isomeria é o estudo de compostos que possuem a mesma fórmula molecular e que apresentam características diferentes devido à diferença de suas estruturas. Ela é extremamente importante para entendermos diferenças de propriedades como ponto de ebulição, por exemplo, entre compostos com mesma fórmula.
A palavra “isômero” vem do grego e quer dizer “partes iguais”. Mas primeiramente devemos entender o que é fórmula molecular.
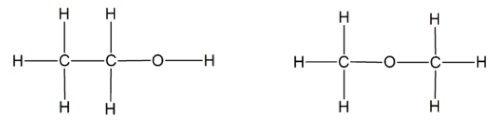
A fórmula molecular é a identidade de uma molécula, nela contém todos os elementos químicos presentes nessa estrutura, bem como o número de átomos de cada um, por exemplo na molécula do etanol C2H6O percebemos que esta molécula é composta por dois átomos de carbono, seis átomos de hidrogênio e um átomo de oxigênio. Um isômero do etanol é o metóximetano, um éter que também possui fórmula molecular C2H6O, e neste exemplo o que diferencia uma substância da outra é a estrutura que veremos abaixo:
O desenvolvimento da Química Orgânica se originou a partir de estudos da Isomeria, pois o primeiro composto orgânico a ser sintetizado em laboratório foi a ureia através de uma reação de isomerização do cianato de amônio. Esta reação foi descoberta e realizada por Friedrich Wohler, químico alemão e então leva o nome de Síntese de Wohler em homenagem.
A isomeria se divide em isomeria plana e isomeria espacial. A isomeria plana, que é a tratada neste artigo, acontece quando a diferença entre as substâncias de mesma fórmula molecular pode ser percebida e explicada através da fórmula estrutural plana dos isômeros diferentemente da isomeria espacial que tratará do arranjo espacial dos átomos. Ela se divide em:
Isomeria de cadeia: ocorre quando a diferença entre os isômeros está no tipo de cadeia embora possuam mesma função orgânica.
Exemplo: pent-1-eno e ciclopentano. Ambos possuem mesma fórmula molecular, ambos são hidrocarbonetos, porém o primeiro é um composto de cadeia aberta e o segundo um composto de cadeia fechada.
Isomeria de compensação: Também é conhecida como metameria e ocorre quando a diferença entre os isômeros está na posição do heteroátomo na cadeia carbônica. Lembrando que um heteroátomo é um átomo diferente de carbono e hidrogênio que se encontra ligado à dois carbonos em uma cadeia (geralmente enxofre, oxigênio ou nitrogênio).
Exemplo: metil-propilamina e dietilamina. Neste caso o nitrogênio que faz parte do grupo funcional das Aminas muda de posição se compararmos as duas estruturas.
Isomeria de posição: Este fenômeno ocorre quando os isômeros diferem quanto à posição de insaturações (duplas ou triplas ligações), do grupo funcional ou de ramificações.
Exemplo: butan-1-ol e butan-2-ol. Neste par de isômeros podemos perceber que a diferença estrutural é encontrada na variação da posição do grupo funcional característico dos álcoois, o OH. Na primeira molécula ele se encontrada ligado ao carbono um e na segunda molécula está ligado no carbono dois.
Isomeria funcional: Neste caso os isômeros não irão pertencer a mesma função orgânica.
Exemplo: propanal e propanona. Ambos possuem a mesma fórmula molecular, porém o primeiro pertence à função Aldeído e a segunda às Cetonas.
Isomeria dinâmica ou tautomeria: Este fenômeno é um caso particular da isomeria de função tratando apenas quando os pares de isômero forem um aldeído e um enol ou uma cetona e um enol. Caracterizando a isomeria aldo-enólica ou ceto-enólica.
Exemplo: Etanal e etenol. O par de isômeros constitui a isomeria aldo-enólica pois o primeiro pertence aos aldeídos e o segundo ao grupo dos enois.
Texto originalmente publicado em https://www.infoescola.com/quimica/isomeria-plana/