Com a efervescência das duas primeiras décadas do século XX, físicos e químicos discutiam a natureza do átomo, dos elétrons e da eletrosfera. Já em 1916 Sommerfeld propusera uma mudança no entendimento das variáveis quânticas do modelo atômico de Rutherford – Bohr.
Louis de Broglie, já em meados da década de 1920, propôs a extensão da dualidade “onda-partícula” ao elétron. Para Broglie, o elétron apresentava comportamento de partícula e de onda, e por este motivo elétrons poderiam apresentar propriedades da mecânica ondulatória. De Broglie postulara o enunciado de que “a todo elétron em movimento está associada uma onda característica”, admitindo este comportamento dualístico e chocando-se diretamente com as proposições anteriores, que afirmavam que o elétron descrevia órbitas circulares ao redor do núcleo.
Esta afirmação foi bastante contestada pelos cientistas contemporâneos de Louis de Broglie, porém experimentos realizados à época comprovaram a tese de que elétrons poderiam apresentar e obedecer à preceitos das leis ondulatórias, como se fossem ondas luminosas.
Seguindo este pressuposto, as órbitas defendidas por Bohr e Sommerfeld não poderiam corresponder à realidade, uma vez que o elétron descreveria o comportamento de uma onda ao redor do núcleo. A figura a seguir demonstra, de maneira bastante simples, como poderia ser descrita a órbita em forma de ondas ao redor do núcleo e o modelo anterior.
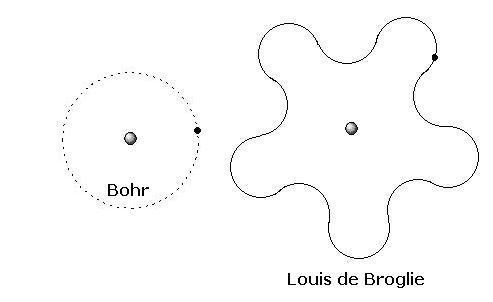
Eletrosferas distintas – Modelo de Bohr e a sugestão de Louis de Broglie
Questões acerca do modelo atômico apresentaram novas discussões quando fora enunciado o princípio da incerteza, por Werner Heisenberg (*1901 – †1967), que afirmava “não ser possível determinar, simultaneamente, a posição e a velocidade de uma partícula em um mesmo instante”. Tal princípio trazia um questionamento aos recentes acontecimentos sobre a eletrosfera: não é possível determinar a posição e velocidades exatas de um elétron.
Este fato trouxe uma nova perspectiva à questão, uma vez que não fazia sentido tentar descrever valores tão exatos dos elétrons. Como definir questões tão intrínsecas ao átomo? Utilizando-se dos conhecimentos da Mecânica ondulatória, diria Erwin Schrödinger.
Erwin Schrödinger (*1887 – †1961) determinou, através de uma infinidade de operações matemáticas (cálculos e equações do movimento de ondas e plotagem dos dados em plano cartesiano), as regiões no espaço que apresentariam máxima probabilidade de se encontrar um elétron. A esta altura a utilização do termo órbita já estava em desuso, pois não se poderia prever, pelo princípio da incerteza de Heisenberg, a posição e velocidade de um elétron. Logo, determinou-se orbital a região que apresentaria máxima probabilidade de localização dos elétrons e, portanto, orbitais se assemelhariam, grosso modo, a nuvens eletrônicas.
Schrödinger, ao propor o modelo de orbitais atômicos, conciliou os postulados teóricos de De Broglie e Heisenberg, formalizando a ideia de que o elétron apresenta comportamento dual (onda – partícula). O modelo atômico de Schrödinger apresentou um modelo de orbital tridimensional para cada um dos subníveis de energia e possibilitou a compreensão do fenômeno da hibridação em átomos de carbono, permitindo a determinação da geometria molecular de diversas substâncias químicas. A geometria molecular, por sua vez permite a previsão de propriedades físicas e químicas de diversos compostos.
O modelo quântico ondulatório ou modelo de orbital obedece à dinâmica dos números quânticos (principal, secundário, magnético e de spin), tendo status de modelo vigente, e sendo válido desde 1923 até os dias atuais.
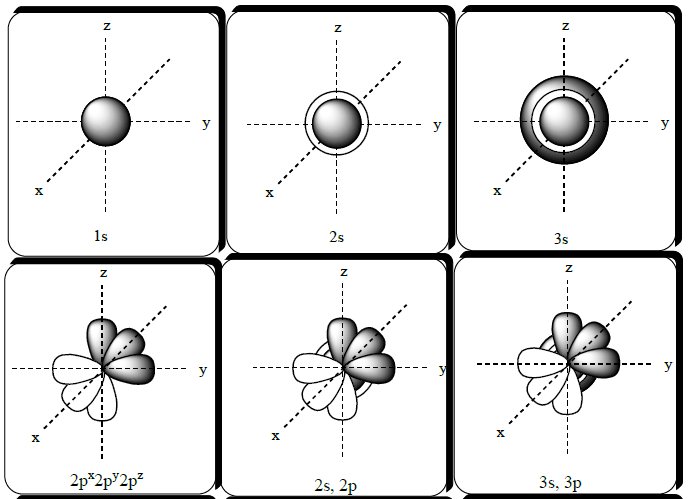
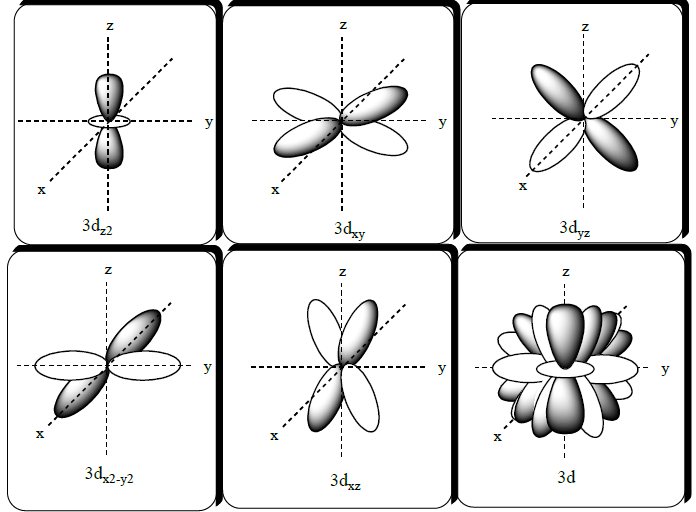
Quadro contendo representações de orbitais.
Referências:
FELTRE, R; YOSHINAGA, S. Atomística – 1ª Ed. – São Paulo: Moderna, 1970. p. 138 – 152.
FELTRE, R. Química Geral – 5ª Ed. – São Paulo: Moderna, 2000. p.108 – 113.
Texto originalmente publicado em https://www.infoescola.com/quimica/modelo-atomico-de-schrodinger/