A química dos compostos de coordenação é uma das áreas mais nobres da química inorgânica. Dentro dela destacam-se os triazenos, espécies químicas pertencentes à família dos sistemas nitrogenados de cadeia aberta que podem atuar como ligantes em complexos, apresentando três átomos de nitrogênio ligados em sequência. Moléculas dessa natureza apresentam uma grande versatilidade nos modos de coordenação quando ligados quimicamente a centros metálicos.1
Na química de coordenação, verifica-se que os compostos do tipo triazenos apresentam grande importância por atuarem como espécies ligantes coordenadas a centros metálicos, agindo como doadores de pares eletrônicos, formando assim um número expressivo de diferentes complexos. A aplicabilidade dos mesmos vai desde a química farmacológica até à química dos materiais.
Um ponto, consideravelmente importante, na síntese dos compostos de coordenação envolvendo este grupo de ligantes encontra-se na desprotonação da cadeia nitrogenada. A retirada do próton acaba proporcionando um aumento da capacidade elétron doadora do ligante. Essa desprotonação pode ocorrer por meio de mecanismos já elucidados pela química inorgânica.
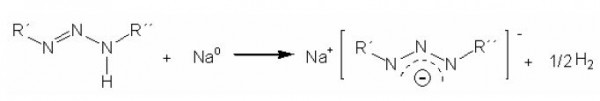
A formação do ânion fornece um forte caráter nucleofílico à espécie. O Esquema 1 apresenta a equação que mostra a desprotonação de um pró-ligante triazenido, o qual utiliza sódio metálico para isso, mas sabe-se que bases inorgânicas, como hidróxido de amônio, de sódio e de potássio, ou ainda aminas orgânicas, como etilienodiamina e trietilamina, podem também ser empregadas com esta finalidade. No esquema pode ser observado que a carga negativa fica deslocalizada entre os três átomos de nitrogênio, conferindo certa reatividade à molécula.
Triazenos permitem diversos modos de coordenação devido à geometria molecular e à presença de sítios doadores de elétrons (bases de Lewis), que permitem a formação de complexos com diversos centros metálicos (ácidos de Lewis).
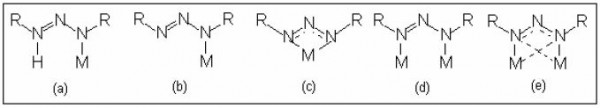
Seus principais modos de coordenação são representados na Figura 1, onde em (a) e (b) mostram-se os modos monodentados terminais com ligante na forma neutra ou aniônica, respectivamente. Em (c) tem-se a representação da forma bidentada do tipo quelato; em (d) e (e) representa-se a coordenação em ponte entre dois centros metálicos.
De acordo com a literatura, os ligantes triazenos atuam mais frequentemente como ponte, Figura 1 (d), entre dois centros metálicos, o que favorece a formação de complexos com interação intermetálica e é estudada em espécies mono e heterometálicas com formação de estruturas poliméricas, sendo essas de maior aplicabilidade no laboratório e na indústria.
Referências:
1. MOORE, D. S. & ROBINSON, S. D.; Adv. Inorg. Chem. Radiochem, 30, 1-68, 1986.
LEE, J. D.; Química Inorgânica Não Tão Concisa, Sãp Paulo, Chapman & Hall, 236-239, 1996.
RUSSELL, John B.; Química Geral vol.1, São Paulo: Pearson Education do Brasil, Makron Books, 1994.
Texto originalmente publicado em https://www.infoescola.com/quimica/modos-de-coordenacao-de-compostos-triazenos/