O termo potencial hidrogeniônico (pH) foi introduzido em 1909 pelo bioquímico dinamarquês Soren Peter Lauritz Sorensen, para expressar concentrações muito pequenas de íons hidrogênio em soluções aquosas, com o objetivo de facilitar seus trabalhos no controle de qualidade de cervejas.
O conceito de pH deriva do produto iônico da água, que é determinado como:
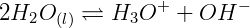
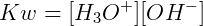
Considerando que em uma água pura a 25ºC, as concentrações molares de H3O+ e OH‒ são iguais e conhecidas, experimentalmente determinamos:
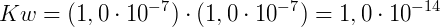
A partir desta conclusão, determinou-se a relação de pH:
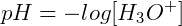
ou
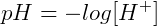
Analogamente, podemos determinar o potencial hidroxiliônico (pOH):
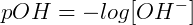
É importante ressaltar que em solução aquosa, as concentrações de íons H3O+ e OH‒ estão relacionadas ao equilíbrio de autoprotólise e, portanto, se uma concentração é aumentada, a outra deve decrescer para manter o valor de Kw.
Condições para que uma solução seja considerada ácida, neutra ou alcalina.
Numericamente, teremos pH = - log [H3O+] = ‒ log 1,0 x 10-7, logo
- se [H3O+] = [OH‒] a solução é neutra, pH = 7,00.
- se [H3O+] > [OH‒] a solução é ácida, pH < 7,00.
- se [H3O+] < [OH‒] a solução é alcalina ou básica, pH > 7,00
As medições de pH utilizam indicadores ou medidores de pH (eletrônicos ou manuais).
Os indicadores são em geral ácidos fracos que são coloridos ou que mudam de cor quando sofrem uma reação ácido-base, ganhando ou perdendo íons H+. Essas reações em geral são reversíveis e ocorrem a cada 10 vezes que a concentração de H+ varia, resultando em uma mudança de uma unidade na escala de pH. Abaixo, encontram-se alguns exemplos de indicadores e suas formas.
| Indicador | Faixa de pH | Cor ácida | Cor básica |
| Violeta de metila | 0 a 1,6 | Amarelo | Violeta |
| Alaranjado de metila | 3,1 a 4,4 | Vermelho | Amarelo |
| Vermelho de metila | 4,8 a 6,2 | Vermelho | Amarelo |
| Azul de bromotimol | 6,0 a 8,0 | Amarelo | Azul |
| Fenolftaleína | 8,2 a 10 | Incolor | Rosa |
Outra forma visual de medir o pH de uma solução é utilizando o papel de tornassol ou fita de pH. O papel de tornassol é um papel indicador que muda de cor na presença de ácidos e de bases, ficando na cor azul quando em presença de uma base e na cor rosa quando na presença de um ácido. Ele não dá informações sobre os valores de pH, apenas da faixa. A fita de pH é um papel que possui uma escala de variação de cor para cada pH, dando uma indicação mais precisa da acidez ou basicidade da solução.
O pHmetro é um aparelho que possui uma membrana sensível à concentração de íons H3O+. Ele dá valores precisos de pH, em geral com duas casas decimais, no entanto, precisa ser calibrado regularmente.
A tabela abaixo apresenta os valores de pH de alguns fluidos comuns.
| Amostra | Valor de pH |
| Suco gástrico (no estômago) | 1,0-2,0 |
| Suco de limão | 2,4 |
| Vinagre | 3,0 |
| Suco de laranja | 3,5 |
| Urina | 4,8-7,5 |
| Água potável | 5,5 |
| Saliva | 6,4-6,9 |
| Leite | 6,5 |
| Água deionizada | 7,0 |
| Sangue | 7,3-7,5 |
| Leite de magnésia | 10,6 |
| Amônia (limpeza doméstica) | 11,5 |
Bibliografia:
Atkins, P.W., Jones, L., Princípios de química: questionando a vida moderna e o meio ambiente 5ª ed., Porto Alegre: Ed. Bookman, 2012.
Usberco J., Salvador E., Química Geral, 12ª.ed., São Paulo: Saraiva, 2006.
http://qnint.sbq.org.br/agua/downloads/descricao.pdf
http://www2.dracena.unesp.br/graduacao/arquivos/quimica_geral/acidosebases.pdf
http://www.portalmedquimica.com.br/arquivos/articleI-Acidez.php.pdf
Texto originalmente publicado em https://www.infoescola.com/quimica/potencial-hidrogenionico/