Uma mistura homogênea, também chamada de solução, é aquela que apresenta uma única fase, ou seja, o soluto não é visível a olho nu. As misturas homogêneas podem ter seus constituintes separados principalmente por meio dos processos abaixo:
Conteúdo deste artigo
Destilação Simples
Representa o processo de fracionamento de soluções mais comum nos laboratórios e nas indústrias químicas, onde muitas vezes é utilizado na purificação de líquidos. É empregado, sobretudo, quando parte-se de uma mistura na qual um de seus constituintes é um sólido dissolvido. Baseia-se na acentuada diferença entre os pontos de ebulição (PE) entre os mesmos; o de menor PE destilará (passará à fase de vapor) primeiro.
Dois fenômenos de natureza física são observados no processo de destilação, o primeiro é a evaporação, onde a solução recebe energia térmica que será convertida na evaporação do componente de menor PE. O segundo é a condensação, quando este componente vaporizado entrará em contato com uma superfície resfriada, retornando à fase líquida.
O esquema de uma destilação simples é mostrado abaixo:
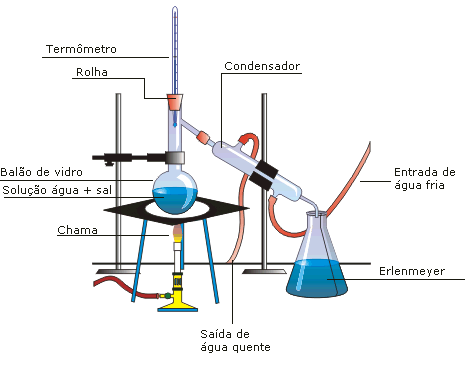
Na figura acima são mostrados os instrumentos laboratoriais necessários ao processo. A mistura poderá ser, por exemplo, uma solução de cloreto de sódio (NaCl) e água, na qual o primeiro (soluto) ficará retido no balão, e o segundo (solvente) será recolhido no erlenmeyer.
Destilação Fracionada
Quando a mistura homogênea for formada por dois líquidos, cujos pontos de ebulição se aproximam mais do que no caso anterior, torna-se então necessário um processo de destilação fracionada. Esse processo é utilizado na indústria no refino do petróleo, onde alguns de seus componentes apresentam pontos de ebulição próximos; o processo é representado abaixo:
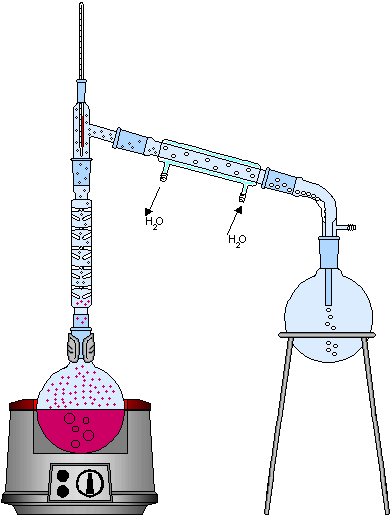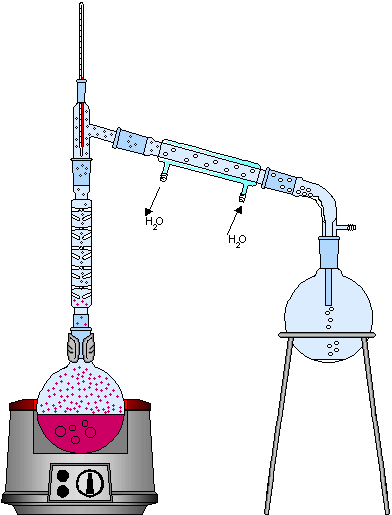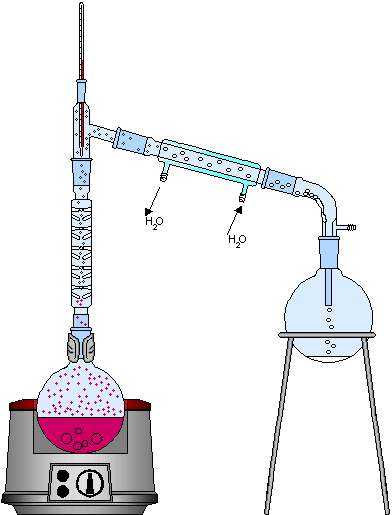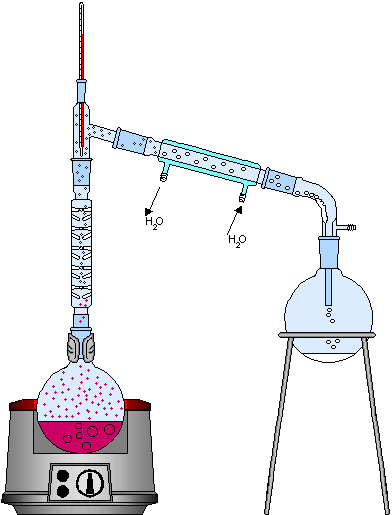 Animação: http://www2.fc.unesp.br/lvq/animations.htm
Animação: http://www2.fc.unesp.br/lvq/animations.htm
A diferença fundamental entre a instrumentação de uma destilação simples e de uma destilação fracionada é o uso no segundo processo de uma coluna de fracionamento, a qual possui a função de aumentar a eficiência do condensador, dificultando que os líquidos se misturem na saída deste.
Destilação por Arraste de Vapor
Esse processo baseia-se na extração de substâncias que se decompõem em temperaturas próximas ao seu ponto de ebulição, e que não são solúveis em água nem em seus vapores. A relativa facilidade de decomposição das substâncias impede a utilização dos processos de destilação simples e fracionada, tornando-se necessário seu “arraste” por meio da água vaporizada. O processo, representado abaixo, é muito comum na indústria fitoterápica, em extrações de constituintes de plantas das mais diversas naturezas.
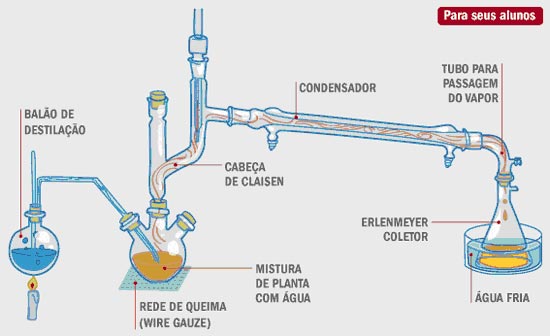 Ilustração: http://revistaescola.abril.com.br/ensino-medio/cheiros-milenares-500064.shtml
Ilustração: http://revistaescola.abril.com.br/ensino-medio/cheiros-milenares-500064.shtml
Observa-se na figura acima que a instrumentação exigida no processo de arraste de vapor é mais detalhada, sendo também necessárias duas fontes de aquecimento ao invés de apenas uma, conforme os processos anteriores. No arraste de vapor deve-se ter o cuidado para que a segunda fonte de aquecimento não degrade os constituintes a seres extraídos, mas também não condense a entrada de vapor de água.
Referências:
SARDELLA, Antônio; MATEUS, Edegar; Curso de Química: química geral, Ed. Ática, São Paulo/SP – 1995.
MAHAN, Bruce M.; MYERS, Rollie J.; Química: um curso universitário, Ed. Edgard Blucher LTDA, São Paulo/SP – 2002
Texto originalmente publicado em https://www.infoescola.com/quimica/processos-de-fracionamento-de-misturas-homogeneas/