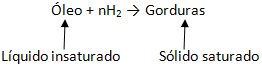A reação de Sabatier-Senderens é outro termo substitutível à hidrogenação catalílica: assim, se baseia na adição de hidrogênio a uma cadeia insaturada (com ligação dupla ou tripla) com auxílio de catalisadores (geralmente utiliza-se o níquel ou a platina).
Na indústria química e alimentícia, este tipo de reação é bastante conhecida, pois com ela pode-se sintetizar margarinas a partir de óleos vegetais (um lipídio líquido com ligações insaturadas e não tão maléficas ao organismo) através da sua hidrogenação à gorduras sólidas (com ligações saturadas e com consequente agravamento de malefícios). Ainda, pode-se sintetizar metano gasoso a partir de dióxido de carbono e hidrogênio, como seguem as reações:
Hidrogenação de óleos:
Hidrogenação do CO2:
CO2+ 4H2 → CH4 + 2H2O ∆H = -165.0 kJ
Verifica-se que a segunda reação (de síntese de metano) foi proposta pelo químico francês Paul Sabatier, sendo então a que recebe seu nome (embora o mecanismo envolva vários outros tipos de reações de hidrogenação – dentre elas, a de alcenos e alcinos hidrogenados à alcanos).
Ela fornece possibilidades que vão desde a produção de hidrogênio (analisando-se a reação reversa) para as mais diversas aplicações a partir de metano e vapor de água (como energia de combustão nos automóveis); até a obtenção de oxigênio livre em localidades na qual se encontra escasso ou nulo (em missões espaciais, pode-se levar uma determinada quantidade de hidrogênio líquido para que, quando houver necessidade, utilizassem-no para produzir O2).
No sentido direto da reação (com os produtos formados à direita da seta), a mesma é exotérmica. Portanto, uma diminuição da temperatura (claramente com um limite tal que as atividades das moléculas envolvidas sejam significantes para que ocorram choques efetivos entre elas) deve favorecê-la. Assim como um aumento de pressão - já que a maior quantidade de matéria encontra-se no lado oposto.
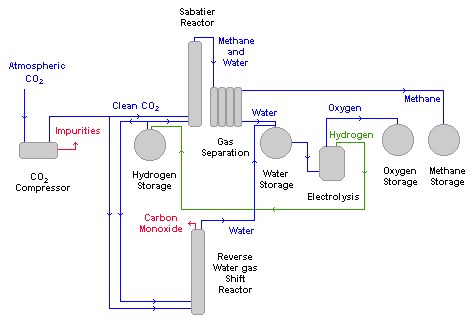
Utiliza-se um reator catalítico com paredes de níquel no processo de síntese:
No esquema acima, o CO2 é comprimido, separado de impurezas, e segue para dois reatores: o de Sabatier e um reverso, este, para síntese exclusiva de água.
A reação entre o dióxido de carbono e o hidrogênio via reator reverso, além de água, tem monóxido de carbono como produto. E, como o valor da constante de equilíbrio é relativamente pequeno – baixo rendimento -, não é muito empregada.
O CO2 que segue para o reator de Sabatier, ao reagir com o hidrogênio, gera metano e água: o metano é retirado para posteriores utilizações, e a água segue para eletrólise. Assim, boa parte do hidrogênio pode ser recuperada para novamente reagir com mais dióxido de carbono e continuar o processo.
Fontes:
https://web.archive.org/web/20210509023518/https://www.soq.com.br/conteudos/em/reacoesorganicas/
http://www.colegioweb.com.br/quimica/hidrogenacao-catalitica-sabatiersenderens.html
Ilustração: http://www.digipac.ca/chemical/mtom/contents/chapter3/sabatier2.htm
Texto originalmente publicado em https://www.infoescola.com/quimica/reacao-de-sabatier-senderens/