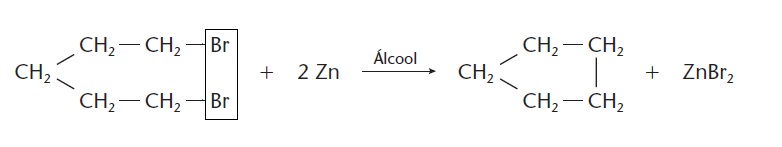As reações de eliminação são reações orgânicas em que ocorre a eliminação de átomos ou grupos de átomos de moléculas, num processo inverso às reações de adição.
As principais reações desse tipo são constituídas pela perda de dois átomos ou grupos adjacentes, formando uma ligação dupla na estrutura. Veja as principais reações de eliminação:
Conteúdo deste artigo
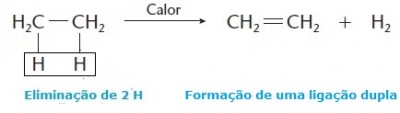
Eliminação de hidrogênio ou desidrogenação
Nesse tipo de reação ocorre a eliminação de dois átomos de hidrogênio (H), ao contrário da hidrogenação. Através da eliminação de hidrogênio é possível converter gorduras saturadas em insaturadas, álcoois em cetonas ou aldeídos (oxidação), alcanos em alcenos, aminas em nitrilas, reações muito úteis em diversos ramos da indústria.
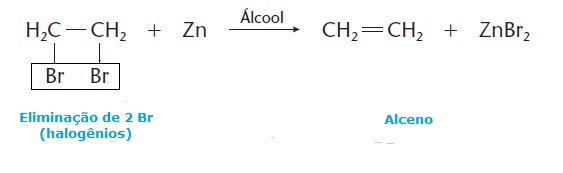
Eliminação de halogênios ou de-halogenação
Halogênios são eletronegativos, por isso, sua eliminação é facilitada pela ação de eletropositivos. Um exemplo de eliminação de halogênios é a reação de brometo de etileno (eletronegativo) com o zinco (eletropositivo), que é catalisada por um álcool e produz um alceno.
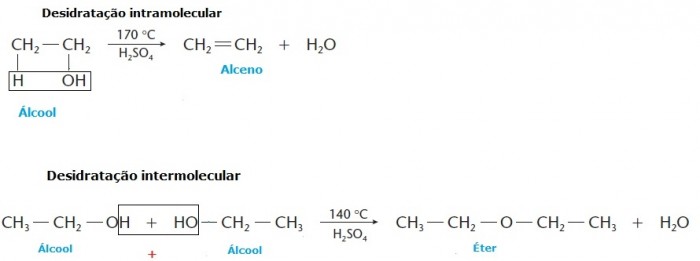
Eliminação de água ou desidratação
Ocorre eliminação de uma ou mais moléculas de água (H2O). Os álcoois, por exemplo, podem sofrer desidratação e esse processo pode ocorrer de duas formas: intramolecular, quando a reação se dá na própria molécula de álcool; ou intermolecular, quando a reação acontece entre duas moléculas de álcool. Álcoois primários tendem a sofrer desidratação intermolecular, produzindo éteres, enquanto os álcoois secundários e terciários costumam desidrata-se de forma intramolecular, formando seus alcenos correspondentes.
Ácidos carboxílicos também podem sofrer eliminação de água, dando origem ao anidrido do ácido correspondente. Um exemplo é a desidratação do ácido acético, que forma o anidrido acético, substância muito utilizada em sínteses orgânicas.
Eliminação de halogenidretos HCl, HBr e Hl ou desidro-halogenação
As reações de desidro-halogenação seguem a regra de Saytzef, que diz que carbonos menos hidrogenados tendem a perder hidrogênio com mais facilidade. Na reação abaixo, por exemplo, existem duas possibilidades de eliminação:
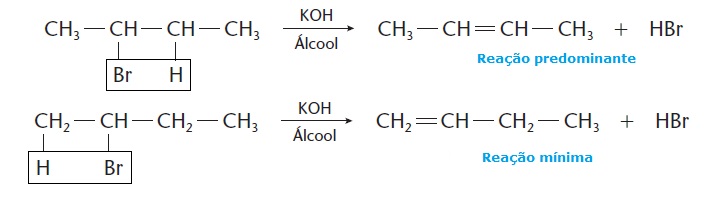
Observe que, nesta reação, a eliminação ocorre por meio da ação de hidróxido de potássio (KOH) em solução alcoólica. O HBr é um ácido e, por isso, é facilmente eliminado da molécula através do KOH, que é uma base.
Eliminações múltiplas
Quando a reação de eliminação ocorre duas vezes na mesma molécula, há a formação de duas ligações duplas ou uma ligação tripla. Exemplo:
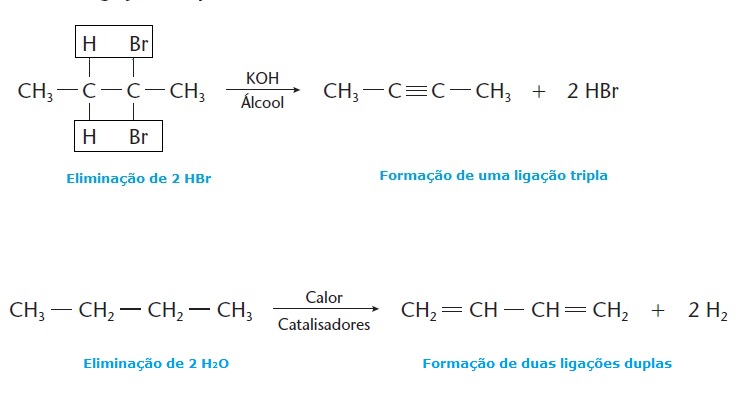
O segundo exemplo consiste numa reação de desidrogenação, muito frequente em indústrias petroquímicas.
Eliminação de átomos ou grupos afastados
Nas reações citadas anteriormente, há a eliminação de átomos ou grupos vizinhos. Porém, a reação de eliminação também pode ocorrer se esses átomos ou grupos estiverem afastados uns dos outros na cadeia carbônica, o que dá origem a um composto cíclico. Observe:
Referências
http://www.iq.usp.br/luizfsjr/QFL2342_2013_04_Eliminacao.pdf
http://www.profpc.com.br/Elimina%C3%A7%C3%A3o.htm
http://paginas.uepa.br/cursinho/apostilas/quimica/3_Ano/quimica_organica_reacoes_organicas_3_Thiago_3.pdf
Texto originalmente publicado em https://www.infoescola.com/quimica/reacoes-de-eliminacao/