Se analisarmos o número atômico (Z), o número de nêutrons (N) e o número de massa (A) de átomos diferentes, será possível identificar e formar conjuntos de átomos com algumas similaridades. Esta propriedade dos átomos recebe o nome de semelhança atômica.
Conteúdo deste artigo
Isótopos
Os isótopos são um conjunto de átomos com o mesmo número de prótons (Z), mas números de massa diferentes.
O número de massa é formado pela quantidade de prótons (número atômico) somada à quantidade de nêutrons de um átomo. Portanto, pode-se concluir que os isótopos são átomos de um mesmo elemento químico (pois apresentam o mesmo número de prótons), porém, com diferentes números de nêutrons. Por exemplo:
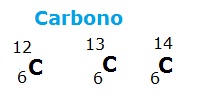
O Hidrogênio é o único elemento químico cujos isótopos têm nome próprio. Os outros isótopos são chamados apenas pelo nome do elemento seguido do número de massa, como, por exemplo, carbono-14, oxigênio-16 e assim por diante.
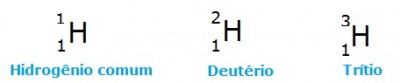
Os isótopos são muito comuns na natureza, mas também podem ser obtidos artificialmente. No grupo dos isótopos artificiais, merecem destaque os radioativos, que são aqueles que emitem determinados tipos de radiação. O flúor-18, por exemplo, é um radioisótopo muito usado na Medicina para mapeamentos ósseos, o fósforo-32 é aplicado à Agricultura para o estudo do metabolismo de vegetais, o carbono-14 é usado na Paleontologia para a datação de fósseis.
Isóbaros
Isóbaros são átomos que apresentam números atômicos diferentes, mas com o mesmo número de massa. Como o número de prótons não é o mesmo, pode-se concluir que os isóbaros pertencem a elementos químicos também diferentes.
O carbono-14 e o nitrogênio são exemplos de são isóbaros, uma vez que ambos possuem número de massa (A) = 14.
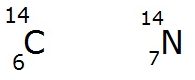
Isótonos
Os átomos que apresentam o mesmo número de neutros, mas números atômicos e de massa diferentes, recebem o nome de isótonos. A isotonia também ocorre entre átomos de elementos químicos diferentes. Como exemplos de isótonos podemos citar o boro (B) e o berílio (Be), que apresentam 6 nêutrons em seus átomos. Observe: 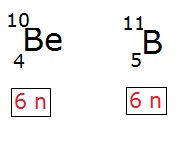
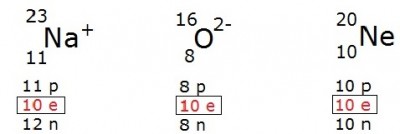
Isoeletrônicos
Átomos neutros apresentam o mesmo número de prótons e elétrons, porém, esses átomos podem ganhar ou perder elétrons, passando a formar íons. Os átomos e íons que apresentam o mesmo número de elétrons são denominados isoeletrônicos. Exemplos:
Referência:
http://www.estudopratico.com.br/isotopos-isobaros-e-isotonos-classificacao-dos-atomos/
Texto originalmente publicado em https://www.infoescola.com/quimica/semelhanca-atomica/