A termoquímica é o ramo da Química que estuda as reações através da quantidade de energia liberada ou absorvida durante o processo reacional. Para saber se um sistema perde ou ganha energia utilizamos a variação de entalpia, representado pelo ∆H, como referência.
A variação de entalpia é definida como a energia em kJ liberada ou absorvida quando o número de moles de reagentes indicado pela equação balanceada descreve a reação completa. A variação de entalpia é calculada da seguinte forma:
∆H= H produtos – H reagentes
Quando a variação de entalpia tem um valor positivo dizemos que a reação é endotérmica e quando a variação de entalpia é um valor negativo a reação é exotérmica.
Uma reação endotérmica é uma reação que recebe calor do ambiente ao redor. Este tipo de reação ocorre quando a energia produzida formando ligações é maior do que a energia necessária para quebrá-las, a partir disso o excesso de calor dessa reação é liberado para o ambiente. Alguns exemplos desse tipo de reação são: todas as reações de combustão, por exemplo a queima de combustível.
Já uma reação exotérmica é uma reação que liberal energia, na forma de calor, para o meio. Ela ocorre quando o calor produzido formando as ligações é menor do que a quantidade necessária para rompe-las, desta forma o sistema precisa absorver energia do ambiente para compensar essa deficiência. Alguns exemplos de reação endotérmicas são: a ebulição da água e a fotossíntese.
Podemos também representar graficamente este tipo de reação, conforme mostrado abaixo:
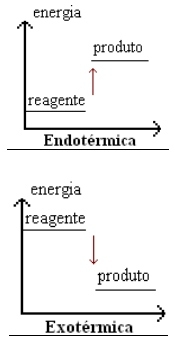
Nas reações endotérmicas a energia começa baixa e aumenta no decorrer da reação.
Nas reações exotérmicas ocorre o inverso, ou seja, a energia começa alta e acaba sendo liberada para o ambiente terminando menor.
Alguns conceitos importantes a respeito da termoquímica são:
Entalpia de Formação ou Calor de Reação: é a energia da reação quando forma 1 mol de substância, a partir das substâncias químicas (elemento no seu estado padrão). O estado padrão é a forma mais estável de uma substância a 25°C e a 1atm de pressão. As substâncias que participam da reação de formação devem ser simples, ou seja, formadas por apenas um elemento químico. A entalpia de formação padrão de uma substância simples é zero.
Exemplo de cálculo a partir de entalpia de formação: Qual o valor da entalpia de combustão do benzeno (C6H6)? Sabendo que C6H6= +80kJ/mol; CO2 = -400 kJ/mol; H2O= -240 kJ/mol
C6H6 + 15/2 O2 → 6CO2 + 3H2O
∆H comb = Hp – Hr
∆H comb = [6x(-400) +3x (-240)] – [ +80 + (15/2 x 0)]
∆H comb = -3200 kJ/mol
Entalpia de combustão: Durante as reações químicas, as ligações químicas são alteradas. Podemos calcular o ΔH pela análise dessas novas ligações formadas. A entalpia de ligação é a variação de entalpia verificada na quebra de 1mol de uma determinada ligação química, sendo que todas as substâncias estejam no estado gasoso, a 25° C e 1atm
Exemplo: Calcule a entalpia através das energias de ligação. Sabendo que H-H = +436kJ; Cl-Cl= +242 kJ; H-Cl= -431 kJ
H2 + Cl2 → 2HCl
(H-H) + (Cl-Cl) 2. (H-Cl)
+ 436 +242 2.(-431)
+678 kJ absorvido -862 kJ liberado
∆H= -184 kJ (Reação exotérmica)
Texto originalmente publicado em https://www.infoescola.com/quimica/termoquimica/