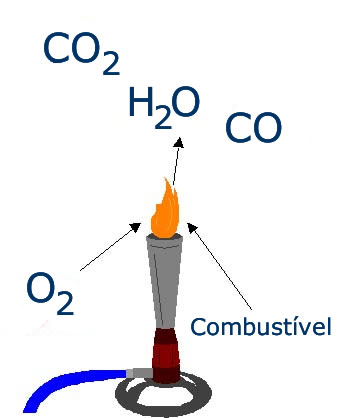
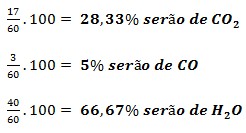A combustão consiste na reação química entre dois ou mais reagentes (combustíveis e comburentes) com grande liberação de energia na forma de calor. Assim, todas as reações de combustão são extremamente exotérmicas (mesmo que necessitem de uma fonte de ignição para ocorrerem).
 Praticamente todos os combustíveis utilizados são orgânicos (com cadeias carbônicas ligadas a átomos de hidrogênio ou oxigênio). Sendo alguns exemplos: a gasolina, o álcool etílico, o acetileno e o metano.
Praticamente todos os combustíveis utilizados são orgânicos (com cadeias carbônicas ligadas a átomos de hidrogênio ou oxigênio). Sendo alguns exemplos: a gasolina, o álcool etílico, o acetileno e o metano.
Da classe dos comburentes, o oxigênio é o mais presente (embora outras substâncias possam ser utilizadas, como o flúor) e a sua função é oxidar o combustível adicionado. Ou seja, a combustão é, na maioria das vezes, uma reação de oxirredução. Onde o oxigênio é o agente oxidante e reduz-se quase sempre ao Nox -2.
Combustão Parcial e Completa
Na indústria, as reações de combustão acontecem a todo o momento e possuem finalidades variadas: desde a geração de vapor para movimentar turbinas e equipamentos, até o fornecimento de energia para iniciar novas reações. E, como a oxidação completa dos combustíveis libera mais energia que a parcial, a mesma se faz mais desejável.
A diferença entre os produtos das duas oxidações (completa e parcial) está na presença do oxigênio nas moléculas: os produtos da combustão completa estão saturados com átomos de oxigênio, ao contrário dos produtos da combustão parcial que possuem a capacidade de absorver mais oxigênio se uma nova combustão lhes for promovida.
Exemplo: 20 mols de metano foram adicionados em um reator de combustão com quantidade suficiente de oxigênio. Em seguida, uma fonte de ignição iniciou a reação que possui 85% de eficiência na produção de dióxido de carbono. Pede-se para calcular a porcentagem molar dos gases de exaustão do reator.
Resolução:
Sejam as respectivas reações de oxidação completa e parcial do metano:
CH4 + 2O2 -> CO2 + 2H2O (85%)
CH4 + 1,5O2 -> CO + 2H2O (15%)
Como a oxidação do metano ocorre com 85% de eficiência, 17 mol se oxidarão completamente e 3 mol se oxidarão parcialmente. Assim, de acordo com a estequiometria da reação, serão formados: 17 mol de CO2, 3mol de CO e 40 mol de H2O (proveniente das duas oxidações).
A soma final do número de mols dos gases é: 17+3+40 = 60 mol , de onde:
Leia também:
Texto originalmente publicado em https://www.infoescola.com/reacoes-quimicas/combustao/