Se um corpo sofre apenas variação na sua temperatura, sem mudança de estado físico, dizemos que o calor é específico (ou sensível). Ele é definido como a quantidade de calor suficiente para alterar a temperatura de uma substância. Mais precisamente, é a quantidade de calor necessária para variar a temperatura de 1g de substância em 1ºC.
Percebemos os efeitos do calor específico pelo tempo que uma substância permanece mais quente que outra, quando ambas, com a mesma temperatura inicial, são aquecidas igualmente. Uma sopa e uma torrada, por exemplo: ambas receberam calor, mas a torrada se esfria mais rapidamente que a sopa. Dessa forma, o calor específico está relacionado com a capacidade do corpo de armazenar energia interna. O termo "específico" caracteriza esta condição de cada substância ter sua capacidade própria de armazenamento, independente de sua massa.
Assim, suponhamos um corpo de massa m, a temperatura inicial T1, receba uma quantidade de calor sensível Q, fazendo sua temperatura aumentar para T2 (Figura 1).
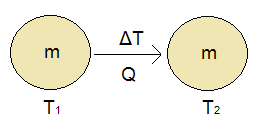
Figura 1: Corpo recebe calor específico Q.
Foi verificado experimentalmente que a quantidade de calor Q recebida é proporcional à massa m e à variação de temperatura ΔT. Logo, concluiu-se:
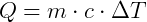
Esta equação é chamada de Equação Fundamental da Calorimetria, onde c é o coeficiente de proporcionalidade que é característico da substância, chamado calor específico. Ele é dado em cal/gºC.
O calor específico da água é chamado de caloria, que é a quantidade de calor necessária para elevar a temperatura de 1 g de água pura de 14,5ºC a 15,5ºC, sob pressão normal (a nível do mar). Pela Equação Fundamental da Calorimetria, obtemos:
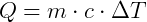
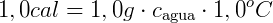
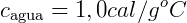
Este é o calor específico da água. Ele varia no intervalo de 0ºC a 100ºC, mas foi aceito ele constante no seu valor médio de 1,0 cal/gºC.
Na tabela a seguir temos os valores do calor específico de algumas substâncias mais comuns:
Na tabela a seguir temos os valores do calor específico de algumas substâncias mais comuns:
| Substância | Calor específico (cal/gºC) |
| água | 1,0 |
| álcool | 0,6 |
| alumínio | 0,22 |
| ar | 0,24 |
| carbono | 0,12 |
| chumbo | 0,031 |
| cobre | 0,091 |
| ferro | 0,11 |
| gelo | 0,5 |
| latão | 0,092 |
| madeira | 0,42 |
| mercúrio | 0,033 |
| ouro | 0,032 |
| oxigênio | 0,22 |
| prata | 0,056 |
| vidro | 0,16 |
Texto originalmente publicado em https://www.infoescola.com/termodinamica/calor-especifico/