Os líquidos, assim como as demais substâncias, se dilatam quando aquecidos. Na maioria das vezes, a dilatação dos líquidos é maior que a dos sólidos. Nos dias quentes, por exemplo, a gasolina pode transbordar do tanque de um carro. Se o sólido com que é feito o carro se dilatasse na mesma taxa, não haveria o transbordamento.
Outro exemplo é o termômetro de mercúrio, cujo tubo é de vidro. A taxa de dilatação do líquido (mercúrio) é maior, pois ele aumenta seu volume mais rapidamente que o tubo (sólido) que o contém. Por isso é possível fazer medições com o mercúrio, sendo este sensível a variações de temperatura.
Por não ter forma própria, os líquidos necessitam de um recipiente para ter a sua forma definida. O líquido não terá comprimento ou área definidos, apenas o volume. Assim, ao estudar a dilatação dos líquidos, devemos considerar a dilatação volumétrica deste e de seu recipiente, visto que o recipiente também sofre a dilatação.
Desta forma, considere um recipiente totalmente cheio de um líquido, ambos a temperatura T1. Elevando a temperatura do conjunto recipiente e líquido a uma temperatura T2, onde T2 > T1, como o recipiente está totalmente completo do líquido, colocamos ao lado um frasco para que o líquido excedente da dilatação venha a transbordar neste. Veja a figura 1 a seguir, que representa esta situação.
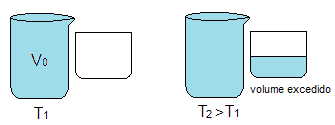
Figura 1. Processo de dilatação do líquido e do frasco.
O líquido que transbordou no frasco colocado posteriormente representa a dilatação aparente do líquido (ΔVap), pois é aquela que percebemos mais facilmente. Mas como o recipiente maior também se dilatou, então o volume do líquido nele é maior agora do que na situação inicial, sendo o volume da quantidade de líquido que aumentou igual ao volume de aumento do recipiente aquecido.
Portanto, a dilatação real do líquido (ΔVreal), que é aquela que realmente aconteceu, é a soma da dilatação do frasco (ΔVfrasco) aquecido mais a dilatação aparente (ΔVap):
ΔVreal = ΔVap + ΔVfrasco
Sabemos que a equação da dilatação volumétrica para os sólidos é usada também para os líquidos, dada por:
ΔV = V0 . γ . ΔT
Aplicando esta equação na dilatação real dos líquidos, obtemos:
ΔVreal = ΔVap + Δvfrasco
(V0 . γreal . ΔT) = (V0 . γap . ΔT) + (V0 . γfrasco . ΔT)
γreal = γap + γfrasco
Esta equação permite que o coeficiente de dilatação real possa ser determinado experimentalmente, pois coeficiente do frasco é de fato conhecido, e o coeficiente da dilatação aparente pode ser determinado por medição direta.
Fazendo
γap = γreal – γfrasco
então podemos concluir:
a) Se γreal > γfrasco : a dilatação aparente é positiva, o líquido se dilata mais que o frasco.
b) Se γreal = γfrasco : a dilatação aparente é nula, o líquido e o frasco se dilatam igualmente.
c) Se γreal < γfrasco : a dilatação aparente é negativa, o líquido se dilata menos que o frasco.
d) Se γfrasco = 0 : a dilatação aparente é igual a dilatação real, o frasco não se dilata.
Referências bibliográficas:
HEWITT, Paul G., Física Conceitual – 9ª ed. – Bookman, 2008.
Texto originalmente publicado em https://www.infoescola.com/termodinamica/dilatacao-dos-liquidos/