Transformação isotérmica é a transformação gasosa cuja temperatura permanece constante. Quanto ao comportamento da pressão e do volume, observe o exemplo no experimento a seguir (figura 1), cujo gás encerrado no interior do êmbolo é um gás perfeito.
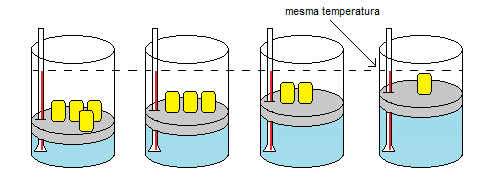
Figura 1. O volume aumenta e a pressão diminui. A temperatura permanece constante.
No experimento acima, foram colocados 4 pesos iguais, garantindo uma força sobre o êmbolo, ou seja, uma pressão inicial maior. Nos estados posteriores, foi-se retirando cada um desses pesos, restando apenas um deles, o que resultou em uma diminuição da pressão. Como a temperatura precisa ser mantida constante, o volume consequentemente foi aumentando com a retirada dos pesos.
Logo, com a diminuição da pressão, o volume tende a aumentar. Esta tendência pode ser observada no Diagrama pV, gráfico representado por uma hipérbole, que relaciona volume e pressão em transformações isotérmicas.
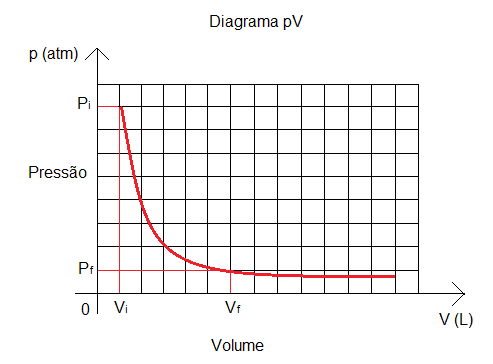
Com base nestes fatos sobre o comportamento de um gás perfeito, quando sua temperatura é constante, estabeleceu-se a Lei de Boyle e Mariotte, enunciada a seguir:
"Para uma determinada massa de gás perfeito, mantida à temperatura constante, a pressão é inversamente proporcional ao volume."
Observando pela Equação de Clapeyron
p . V = n . R . T
como n, R e T são constantes, obtemos
p . V = constante
verificando que a pressão é inversamente proporcional ao volume.
É importante notar que a hipérbole no Diagrama pV representa a curva para apenas uma temperatura, pois esta é constante. Para outras curvas neste mesmo diagrama, representando temperaturas maiores, temos um padrão de hipérboles equiláteras assíntotas aos eixos coordenados. Quanto mais estas hipérboles se afastam da origem, maior a temperatura na transformação isotérmica.
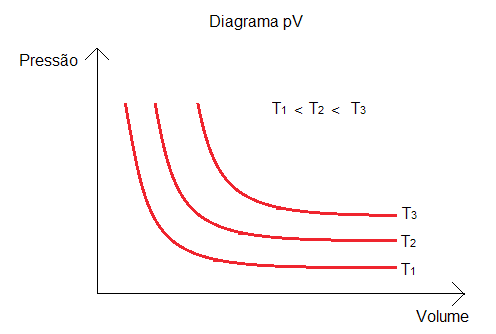
Observando o Diagrama pV acima, cada uma das três curvas representa uma transformação isotérmica, a temperatura constante.
Texto originalmente publicado em https://www.infoescola.com/termodinamica/transformacao-isotermica/