A matéria pode se apresentar em diferentes estados físicos. São eles:
- Sólido: forma própria e volume bem definido, as moléculas que compõem o corpo vibram em torno de uma posição fixa;
- Líquido: sem forma própria, assume a forma do recipiente em que está contido, mas com o seu volume ainda bem definido. As moléculas já não ficam vibrando em uma posição fixa, mas ainda estão ligadas entre si, indo de um lugar para o outro;
- Gasoso: nem forma nem volume definidos, assumindo as do recipiente em que está, com as moléculas não mais ligadas entre si, indo para qualquer direção no volume em que estiver.
Dependendo de fatores, como temperatura e pressão, a matéria pode sofrer mudança de estado, que seria a alternância entre os estados sólido, líquido e gasoso. Veja na figura 1, a seguir, os nomes destas mudanças.
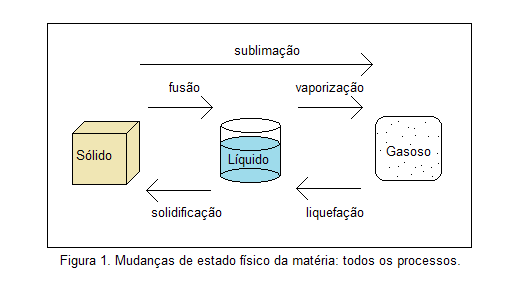
Aqui estudaremos mais a fundo a mudança de estado denominada vaporização. Ela é caracterizada pela mudança do estado líquido para o estado gasoso e isso pode ocorrer de três formas: ebulição, evaporação e calefação. Vejamos as características de cada um a seguir.
Conteúdo deste artigo
Ebulição
Neste processo, a passagem do estado líquido para o gasoso ocorre em toda a massa líquida. Isso acontece quando a pressão de vapor do líquido se iguala à pressão externa, começando a escapar este vapor para a atmosfera. Para que o líquido entre em ebulição é preciso que chegue a uma temperatura determinada, a temperatura de ebulição, que é um valor característico para cada líquido.
Sob pressão normal, a nível do mar, a temperatura de ebulição da água é 100ºC, por exemplo. Quanto maior a altitude do local, menor será a pressão e menor será a temperatura de ebulição. No Monte Everest, montanha mais alta da Terra, cujo pico está a 8.848 m de altura em relação ao nível do mar, a temperatura de ebulição da água é de 75º C.
Evaporação
A passagem do estado líquido para o gasoso, na evaporação, ocorre de forma lenta e apenas na superfície do líquido. Um líquido, em qualquer temperatura, possui partículas que estão com uma energia cinética média, umas mais rápidas, outras mais lentas. Devido as colisões intermoleculares entre elas, as que estavam lentas podem ficar rápidas e vice-versa. Na ocorrência deste fenômeno, as partículas que se encontram na superfície são bombardeadas pelas partículas que estão abaixo, ganhando grande quantidade de energia cinética, a ponto de algumas saírem do líquido em direção à atmosfera, tornando-se moléculas de vapor.
Ao se desprender do líquido, as moléculas que estavam com a energia cinética alta logo ao sair, tendem a diminuir esta energia. Isso acontece devido a uma atração que existe entre elas e as que ficaram no líquido. Assim, estas moléculas de vapor que estão logo acima do líquido possuem uma baixa energia e causam um resfriamento imediatamente acima do líquido. Este efeito de resfriamento é notado com o álcool comum, que evapora rapidamente e, ao ser passado na pele, sentimos de imediato o resfriamento.
Graças as glândulas sudoríparas do corpo humano, que produzem a transpiração, o processo de evaporação do suor faz com que o corpo sofra um resfriamento, equilibrando sua temperatura. Alguns animais não possuem estas glândulas sudoríparas e precisam estar em lugares de menor temperatura para se refrescar, como os porcos, que ficam na lama. Outros animais usam outros recursos, como os cachorros, que o fazem por meio da respiração, ocorrendo a evaporação pela sua boca e no interior do tubo bronquial.
Não há uma temperatura específica do líquido para que a evaporação ocorra, como no caso da ebulição. Por isso que ao deixamos a roupa no varal ou uma bacia com água (ou qualquer outro líquido) ao ar livre, a evaporação ocorre aos poucos e constantemente. Mas sabemos que quanto maior a temperatura do líquido, mais rápida será a evaporação. Outros fatores que ajudam a acelerar a evaporação são:
- o tipo de líquido (uns são mais propícios a evaporação que outros – volatilidade);
- a pressão exercida sobre o líquido, pois quanto menor for, mais rápido será o processo; e
- a superfície de contato exposta ao ambiente, devendo ser a maior possível.
Calefação
Neste processo, o líquido é submetido a uma transmissão rápida de calor, de forma que a superfície do líquido atinge o ponto de ebulição antes que o seu interior venha a se aquecer, ocorrendo imediatamente a vaporização já na superfície do líquido. A superfície que transmite o calor para o líquido deve estar com a temperatura maior que o ponto de ebulição do líquido em contato. É o que ocorre ao borrifar gotas de água em uma chapa quente, por exemplo.
Referências bibliográficas:
HEWITT, Paul G., Física Conceitual – 9ª ed. – Bookman, 2008.
Texto originalmente publicado em https://www.infoescola.com/termodinamica/vaporizacao/